Ein Schub für die Pflanzenforschung
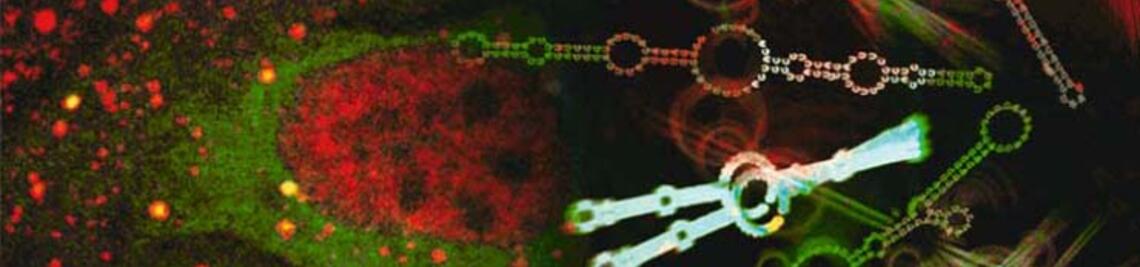
16.02.2021Mit Hilfe der Optogenetik lassen sich Zellen gezielt mit Licht aktivieren und erforschen. Wissenschaftlern der Universität Würzburg ist es jetzt gelungen, diese Technik auf Pflanzen zu übertragen.
Knapp zehn Jahre ist es her, dass das Wissenschaftsmagazin Science die Optogenetik als „Durchbruch des Jahrzehnts“ bezeichnet hat. Die Technik ermöglicht es, vereinfacht gesagt, die elektrische Aktivität von Zellen mit Lichtpulsen zu steuern. Mit ihrer Hilfe können Wissenschaftlerinnen und Wissenschaftler beispielsweise neue Einblicke in die Funktionsweise von Nervenzellen gewinnen und damit neurologische und psychiatrische Krankheiten, wie etwa Depression und Schizophrenie, besser verstehen.
Etabliertes Verfahren an tierischen Zellen
In der Forschung an tierischen Zellen ist die Optogenetik inzwischen eine etablierte Technik, die in vielen Bereichen zum Einsatz kommt. Anders das Bild in der Pflanzenforschung: Die Übertragung des Prinzips auf Pflanzenzellen und dessen breite Anwendung war bislang nicht möglich.
Das allerdings hat sich jetzt geändert: Wissenschaftlerinnen und Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU) ist es gelungen, optogenetische Verfahren in Tabakpflanzen anzuwenden. Die Ergebnisse ihrer Arbeit stellen sie in der aktuellen Ausgabe der Fachzeitschrift Nature Plants vor.
„Insbesondere Dr. Kai Konrad aus der Arbeitsgruppe von Professor Rainer Hedrich (Botanik I) und Dr. Shiqiang Gao aus meiner Gruppe waren hierbei für den Erfolg dieses Projekts hauptverantwortlich“, erklärt Professor Georg Nagel, Mitbegründer der Optogenetik. An der Zusammenarbeit waren – neben der Abteilung Neurophysiologie im Physiologischen Institut – drei Lehrstühle des Julius-von-Sachs-Instituts der JMU beteiligt: die Botanik I, Botanik II und die Pharmazeutische Biologie.
Lichtschalter für die Zellaktivität
„Unter Optogenetik versteht man die Manipulation von Zellen oder Lebewesen durch Licht, nachdem mit gentechnischen Verfahren ein ‚Lichtsensor‘ in diese eingebracht wurde. Insbesondere der lichtgesteuerte Kationenkanal Channelrhodopsin-2 hat der Optogenetik zu einem Durchbruch verholfen“, beschreibt Nagel das von ihm mitentwickelte Verfahren. Mit Hilfe des Channelrhodopsins kann die Aktivität von Zellen quasi wie mit einem Lichtschalter an- und ausgeknipst werden.
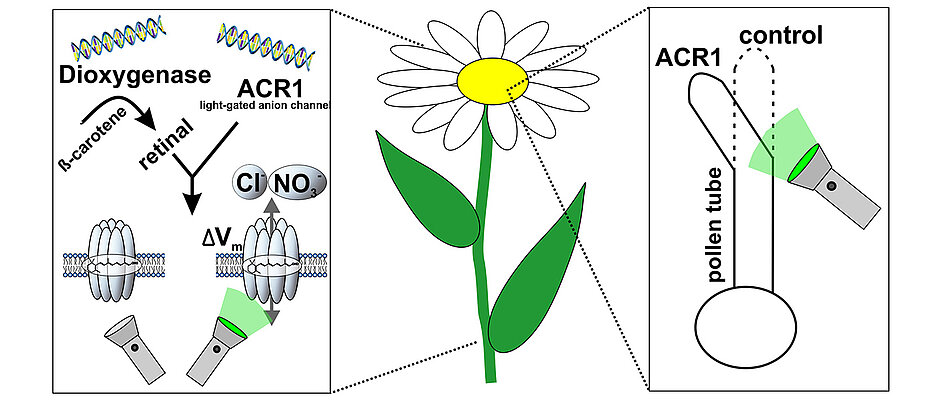
In Pflanzenzellen hat dies bislang allerdings nur eingeschränkt geklappt. Verantwortlich dafür waren vor allem zwei Gründe: „Es ist schwer, Pflanzen genetisch so zu verändern, dass sie Rhodopsine funktionell bilden. Darüber hinaus fehlt ihnen ein entscheidender Ko-Faktor, ohne das Rhodopsine nicht funktionieren können: das all-trans-Retinal, auch Vitamin A genannt“, erklärt Dr. Gao.
Grünes Licht für Pflanzenzellen
Beide Probleme konnten Professor Nagel, Dr. Gao und Dr. Konrad und Kollegen jetzt lösen. Ihnen ist es gelungen, Vitamin-A in Tabakpflanzen mittels eines eingebrachten Enzyms aus einem marinen Bakterium zu produzieren und damit einen verbesserten Einbau von Rhodopsin in die Zellmembran zu ermöglichen. Dies erlaubt erstmals eine nicht-invasive Manipulation von intakten Pflanzen oder ausgewählten Zellen durch Licht über das sogenannte Anionenkanalrhodopsin GtACR1.
In einem früheren Ansatz hatten die Pflanzenphysiologen aus der Botanik I den dringend notwendigen Ko-Faktor Vitamin A den Zellen künstlich zugefügt, um einen lichtgesteuerten Kationenkanal in Pflanzenzellen aktiv werden zu lassen. Mit Hilfe des jetzt vorgestellten genetischen Tricks haben Nagel und seine Kollegen nun Pflanzen erzeugt, die neben einem Rhodopsin ein spezielles Enzym produzieren – die sogenannte Dioxygenase – und damit in der Lage sind, aus dem Provitamin A das in der Pflanze nicht vorkommende Vitamin A selbst herzustellen. Die Kombination von Vitamin-A-Produktion und Optimierung von Rhodopsinen für die pflanzliche Anwendung führte die Forscher letztendlich zum Erfolg.
Neuer Ansatz für die Pflanzenforschung
„Bestrahlt man diese Zellen mit Grünlicht, steigt die Durchlässigkeit der Zellmembran für negativ geladene Teilchen stark an, und das Membranpotenzial verändert sich deutlich“, erklärt Dr. Konrad. Auf diese Weise sei es möglich, beispielsweise das Wachstum von Pollenschläuchen und die Entwicklung der Blätter gezielt zu manipulieren und so die molekularen Mechanismen pflanzlicher Wachstumsprozesse detailliert zu untersuchen. Dieser neuartige optogenetische Ansatz für die Pflanzenforschung werde in Zukunft die Analyse von bislang unverstandenen Signalwegen erheblich erleichtern, sind sich die Forscher aus Würzburg sicher.
Ein Pionier der Optogenetik
Rhodopsin ist ein von Natur aus lichtempfindliches Pigment, das die Basis der Sehkraft vieler Lebewesen bildet. Dass sich eine lichtempfindliche Ionenpumpe aus Archaebakterien (Bacteriorhodopsin) in Wirbeltierzellen einbauen lässt und dort funktioniert, hat Georg Nagel 1995 zusammen mit Ernst Bamberg am Max-Planck-Institut für Biophysik in Frankfurt erstmals nachgewiesen. 2002/2003 gelang dieser Nachweis dann auch mit lichtempfindlichen Ionenkanälen aus Algen.
Gemeinsam mit Peter Hegemann zeigte Nagel in zwei 2002 und 2003 veröffentlichten Arbeiten die Existenz von zwei lichtempfindlichen Kanalproteinen, Channelrhodopsin-1 und Channelrhodopsin- 2 (ChR1/ChR2), auf. Entscheidend war die Entdeckung, dass ChR2 eine extrem schnelle, lichtinduzierte Veränderung des Membranstroms und der Membranspannung auslöst, wenn das Gen in Wirbeltierzellen exprimiert wird. Außerdem ist ChR2 durch seine geringe Größe sehr einfach in der Anwendung.
Für diese Entdeckung wurde Nagel mittlerweile vielfach ausgezeichnet, zuletzt im Jahr 2020 – gemeinsam mit zwei weiteren Pionieren der Optogenetik – mit dem mit 1,2 Millionen US-Dollar dotierten Shaw-Preis für Biowissenschaften.
Originalpublikation
„Optogenetic control of plant growth by a microbial rhodopsin“, Yang Zhou, Meiqi Ding, Shiqiang Gao, Jing Yu-Strzelczyk, Markus Krischke, Xiaodong Duan, Jana Leide, Markus Riederer, Martin J. Mueller, Rainer Hedrich, Kai R. Konrad, Georg Nagel. Nature Plants. http://dx.doi.org/10.1038/s41477-021-00853-w
Kontakt
Prof. Dr. Georg Nagel, Universität Würzburg, Physiologisches Institut – Abteilung Neurophysiologie, T: +49 931 318 6143, nagel@uni-wuerzburg.de
Dr. Kai R. Konrad, Universität Würzburg, Julius-von-Sachs Institut – Botanik I, T: +49 931 318 1413, kai.konrad@botanik.uni-wuerzburg.de