Energie für eine ungestörte Ruhe
29.07.2021Ein Hormon sorgt bei der Taufliege Drosophila für ein Gleichgewicht zwischen Ruhe und Aktivität. Das zeigt eine neue Studie eines Forschungsteams unter Leitung der Universität Würzburg. Besitzt auch der Mensch ein vergleichbares Hormon?
Nahrung suchen, fressen, ruhen: Etwas platt formuliert ist das in etwa der Lebensrhythmus, dem viele Tiere folgen. Gut aufeinander abgestimmt sorgen diese drei Phasen für das nötige Gleichgewicht zwischen Energiegewinnung – dem Fressen – und Energieverbrauch – der täglichen Aktivität. Wichtig in diesem Wechselspiel ist dabei eine klare zeitliche Regelung. Schließlich wäre es nicht allzu sinnvoll, sich während der Schlafphase hungrig auf die Suche nach Futter zu begeben.
Welche neurophysiologischen Prozesse und Strukturen die zeitliche Koordination des Verhaltens regeln: Diese Frage steht im Mittelpunkt der Forschung am Lehrstuhl für Neurobiologie und Genetik der Julius-Maximilians-Universität Würzburg (JMU). Vor allem die Taufliege Drosophila melanogaster, die sich vergleichsweise einfach genetisch manipulieren lässt, ist dabei Untersuchungsobjekt der Wissenschaftlerinnen und Wissenschaftler. Christian Wegener ist Professor am Lehrstuhl und konzentriert sich auf Neuropeptid-Signalsysteme, die bei der Taufliege an der zeitlichen Abstimmung zwischen inneren Uhren, Verhalten und Metabolismus beteiligt sind.
Balance zwischen Ruhephasen und Nahrungssuche
Jetzt ist es dem Arbeitskreis um Wegener und seinem Kollegen Dr. Dennis Pauls in Zusammenarbeit mit Partnern am Lehrstuhl für pharmazeutische Biologie und den Unis Leipzig, Uppsala und Graz gelungen, einen hormonellen Regelkreis zu identifizieren, der an der Balance zwischen Ruhephasen und Nahrungssuche beziehungsweise Nahrungsaufnahme beteiligt ist. In der aktuellen Ausgabe der Fachzeitschrift Current Biology stellt das Team die Ergebnisse seiner Arbeit vor.
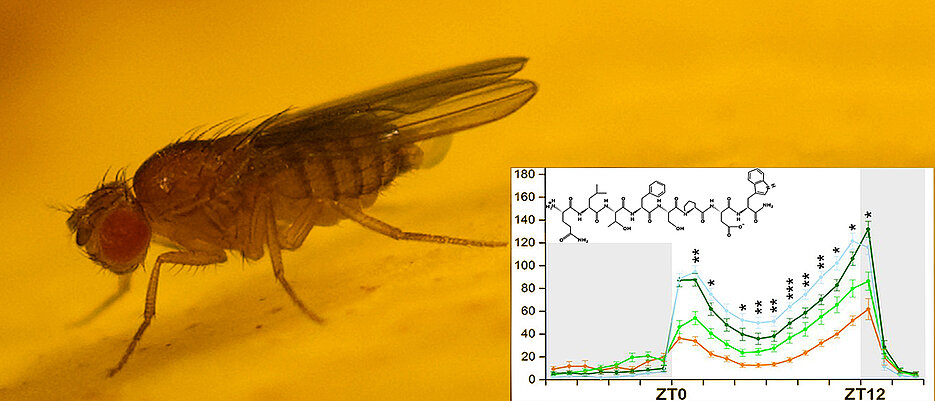
Für die neue Studie wurden neurogenetische, mikroskopische und metabolomische Methoden miteinander kombiniert. Das Interesse des Teams galt dabei einem Hormon, das für die Energiebereitstellung notwendig ist – das sogenannte adipokinetische Hormon AKH. Dieses Hormon übernimmt bei der Fliege ähnliche Funktionen wie Glukagon bei Säugern.
„AKH sorgt dafür, dass der Fliege nicht die Energie ausgeht, wenn sie mal längere Zeit nichts zu Fressen bekommt, indem es über einen speziellen Regelkreis Zucker aus ihrem Fettkörper freisetzt“, erklärt Wegener. Gleichzeitig aktiviere AKH bestimmte aminerge Neurone eines Stress-Systems von Drosophila. „Wir konnten jetzt zeigen, dass AKH über diese zwei verschiedenen Wege sowohl die Nahrungsaufnahme als auch das Aktivitätslevel der Taufliegen balanciert“, fasst Pauls, der mittlerweile an die Uni Leipzig gewechselt ist, das zentrale Ergebnis der jetzt veröffentlichten Studie vor.
Hormonblockade führt zu verkürzter Nachtruhe
Schalteten die Forschenden mit Hilfe der Gentechnik die AKH-abhängige Energiemobilisierung aus, dann hatten die Fliegen in der Folge eine kürzere Nachtruhe. Sie wurden schon am Ende der Nacht vorzeitig aktiv, um Nahrung zu suchen. „AKH scheint also die Nachtruhe, in der die Tiere nicht fressen, zu stabilisieren, indem es Energie aus dem Fettkörper verfügbar macht“, interpretiert Wegener das Ergebnis.
In einem weiteren Experiment schalteten die Wissenschaftlerinnen und Wissenschaftler die AKH-abhängige Aktivierung des Stress-Systems der Taufliege aus. Die Folge: „Die betroffenen Tiere haben während des Tages eine verminderte physische Aktivität gezeigt.“ Pauls und Wegener schließen daraus, dass das Hormon AKH tagsüber bei Drosophila nicht nur die Energie für die physische Aktivität zur Verfügung stellt, sondern auch diese Aktivität selbst ankurbelt.
Auf der einen Seite erhöhe das Hormon also die Aktivität der Fliege, indem es spezielle Neuronen eines Stress-Systems anregt. Auf der anderen Seite mobilisiere das Signal in Phasen des Nahrungsmangels die Bereitstellung von Energie in Form von Zucker aus dem Fettkörper und sorge so unter anderem für einen ungestörten Schlaf, indem die Fliege zumindest nicht von Hungergefühlen geweckt wird.
Dementsprechend lautet das Fazit der Forschenden. „Unsere Ergebnisse fügen den bereits bekannten, vielseitigen regulatorischen Funktionen von AKH-produzierenden Zellen eine neue Facette hinzu, indem sie zeigen, dass ihr Output dazu beiträgt, das tägliche Aktivitätsmuster bei freiem Zugang zu Nahrung zu formen.“
Wechselwirkung zwischen Schlafqualität und Fettleibigkeit
Auch wenn die Verwandtschaft zwischen Taufliege und Mensch zumindest für den Laien nicht allzu groß erscheint: Auf zellulärer und physiologischer Ebene spricht viel dafür, dass vergleichbare Signalketten im menschlichen Organismus zu finden sind. „Der Mensch verfügt über ähnliche metabolische Hormone, beispielsweise Glukagon“, sagt Wegener. Deshalb liege der Schluss nahe, dass ähnliche Hormone auch beim Menschen und bei anderen Säugern eine entsprechende Rolle bei der Stabilisierung von Ruhe- und Schlafphasen spielen könnten. Dafür spricht auch die Tatsache, dass Wechselwirkung zwischen Schlafqualität und Stoffwechselstörungen beim Menschen gut dokumentiert sind.
Originalpublikation
Endocrine signals fine-tune daily activity patterns in Drosophila. Dennis Pauls, Mareike Selcho, Johanna Räderscheidt, Kelechi M. Amatobi, Agnes Fekete, Markus Krischke, Christiane Hermann-Luibl, Ayten Gizem Ozbek-Unal, Nadine Ehmann, Pavel M. Itskov, Robert J. Kittel, Charlotte Helfrich-Förster, Ronald P. Kühnlein, Martin J. Mueller and Christian Wegener, Current Biology. DOI: https://doi.org/10.1016/j.cub.2021.07.002
Kontakt
Prof. Dr. Christian Wegener, Lehrstuhl für Neurobiologie und Genetik, T: +49 931 31-85380, christian.wegener@uni-wuerzburg.de