Der Drucksensor der Venusfliegenfalle
11.12.2020Das Display eines Smartphones reagiert auf Fingerdruck. Die fleischfressende Venusfliegenfalle dagegen bemerkt sogar, wenn ein Leichtgewicht wie eine Fliege auf ihr landet. Spezielle Gene machen das möglich.
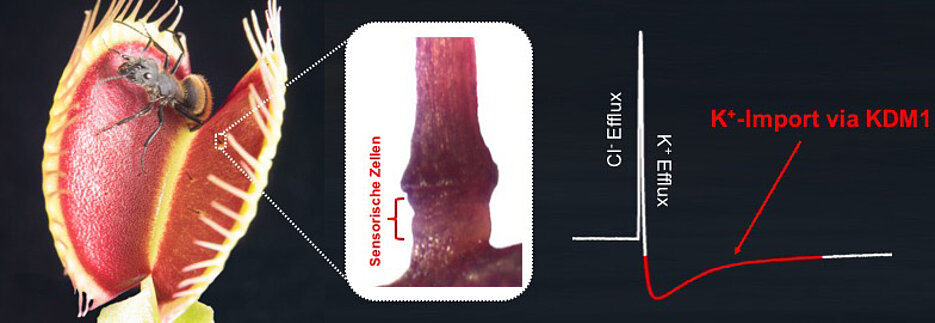
Alle Pflanzenzellen lassen sich durch Berührungen oder Verletzungen zu Reaktionen bewegen. Die fleischfressende Venusfliegenfalle (Dionaea muscipula) besitzt dafür hochsensible Organe: Sinneshaare, die selbst schwächste mechanische Reize registrieren, verstärken und in elektrische Signale umwandeln, die sich dann schnell im Pflanzengewebe ausbreiten.
Ein Forschungsteam der Julius-Maximilians-Universität (JMU) Würzburg hat einzelne Sinneshaare isoliert und darin den Genpool analysiert, der beim Fangen von Insekten aktiv ist. "Dabei haben wir erstmals die Gene gefunden, die vermutlich im ganzen Pflanzenreich dazu dienen, lokale mechanische Reize in systemische Signale umzuwandeln", sagt JMU-Pflanzenforscher Professor Rainer Hedrich.
Das ist eine feine Sache, denn über die Mechano-Rezeptoren in Pflanzen war bislang so gut wie nichts bekannt. Das Team um Hedrich stellt die Ergebnisse im Open-Access-Journal PLOS Biology vor.
Sinneshaare wandeln Berührung in Elektrik um
Die Klappfalle von Dionaea besteht aus zwei Hälften, die je drei Sinneshaare tragen. Wird ein Haar durch eine Berührung gebogen, entsteht an seiner Basis ein elektrisches Signal, ein Aktionspotential. An der Haarbasis sitzen Zellen, bei denen durch eine Dehnung ihrer Hüllmembran Ionenkanäle aufspringen und elektrisch leitend werden. Der obere Teil des Sinneshaares wirkt als Hebel, der den selbst durch leichteste Beutetiere ausgelösten Reiz verstärkt.
Diese Mikro-Kraft-Berührungssensoren verwandeln den mechanischen Reiz also in ein elektrisches Signal, das sich vom Haar über die ganze Klappfalle ausbreitet. Nach zwei Aktionspotentialen schnappt die Falle zu. Anhand der Zahl der Aktionspotentiale, die das Beutetier bei seinen Befreiungsversuchen auslöst, schätzt die fleischfressende Pflanze ab, ob die Beute groß genug ist - ob es sich lohnt, die aufwändige Verdauung in Gang zu setzen.
Von den Genen zur Funktion des Berührungssensors
Um die molekularen Grundlagen für diese einzigartige Funktion zu erforschen, hat Hedrichs Team etwa 1000 Sinneshaare "geerntet". Zusammen mit dem JMU-Bioinformatiker Professor Jörg Schultz machte man sich daran, die Gene in den Haaren zu identifizieren.
„Dabei fiel uns auf, dass sich der Fingerabdruck der im Haar tätigen Gene von dem der anderen Zelltypen der Falle unterscheidet“, sagt Schulz. Wie wird der mechanische Reiz in Elektrizität umgesetzt? „Um das zu beantworten, haben wir uns auf die Ionenkanäle konzentriert, die im Sinneshaar exprimiert sind oder ausschließlich dort vorkommen", so Hedrich.
Auf der Suche nach weiteren Ionenkanälen
Dabei stach der sinneshaarspezifische Kaliumkanal KDM1 heraus. Mit neu entwickelten elektrophysiologischen Methoden zeigte sich, dass ohne diesen Kanal die elektrische Erregbarkeit der Sinneshaare verloren geht, dass diese also keine Aktionspotentiale mehr feuern können. „Jetzt gilt es, die Ionenkanäle zu identifizieren und zu charakterisieren, die in den frühen Phasen des Aktionspotentials eine wichtige Rolle spielen", so Hedrich.
Publikation
"The Venus flytrap trigger hair-specific potassium channel KDM1 can reestablish the K+ gradient required for hapto-electric signaling". Anda L. Iosip, Jennifer Böhm, Sönke Scherzer, Khaled A. S. Al-Rasheid, Ingo Dreyer, Jörg Schultz, Dirk Becker, Ines Kreuzer, Rainer Hedrich. PLOS Biology, 9. Dezember 2020, https://doi.org/10.1371/journal.pbio.3000964
Kontakt
Prof. Dr. Rainer Hedrich, Lehrstuhl für Botanik I (Pflanzenphysiologie und Biophysik), Universität Würzburg, T +49 931 31-86100, hedrich@botanik.uni-wuerzburg.de