Netzwerker unter beengten Umständen
24.01.2024Mehr als 1.000 Akteure sind in einer Zelle daran beteiligt, wenn genetische Information in Proteine übersetzt wird. Ein neues deutsch-israelisches Forschungsprojekt arbeitet daran, deren jeweilige Aufgabe zu identifizieren.
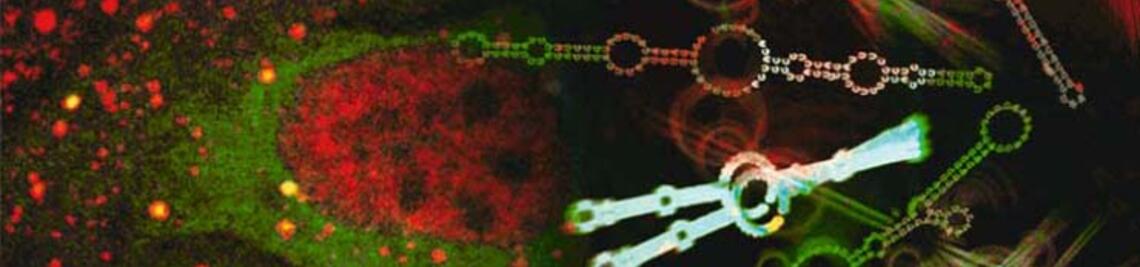
Wenn in den Zellen des Menschen genetische Information aus dem Zellkern ins Zellplasma transportiert und dort in Proteine übersetzt werden soll, kommt einem bestimmten Molekül eine zentrale Rolle zu: der mRNA – vom englischen messenger RNA oder übersetzt: der Boten-RNA. Damit diese mRNA ihre Arbeit nach Plan erledigen kann, benötigt er allerdings jede Menge Unterstützung. Rund 1.000 unterschiedliche Beteiligte hat die Wissenschaft in den vergangenen Jahren identifiziert, die an diesem Prozess mitwirken.
Deren Funktion und Struktur detailliert zu entschlüsseln, hat sich ein neues deutsch-israelisches Forschungsprojekt zum Ziel gesetzt. Daran beteiligt sind Forschungsgruppen der Universitäten in Regensburg und Würzburg sowie am Weizmann Institute of Science in Israel in der Nähe von Tel Aviv. Professor Utz Fischer, Inhaber des Lehrstuhls für Biochemie, ist an der Julius-Maximilians-Universität Würzburg (JMU) dafür verantwortlich.
Essenziell für das Funktionieren jedes Lebewesens
„Im Kern unseres Forschungsprojekts steht die Frage nach der Stabilität von mRNA-Molekülen“, erklärt Utz Fischer. Schließlich wirkt sich die Stabilität wesentlich auf die Funktion aus, unter anderem, weil davon die Produktionsmenge der jeweils kodierten Proteine abhängt. Wie die Stabilität langer RNAs durch das Zusammenspiel von Sequenz, Struktur, chemischen Modifikationen und RNA-bindenden Proteinen bestimmt wird, ist noch wenig bekannt. Dabei ist dieses Zusammenspiel essenziell für das Funktionieren eines jeden Organismus.
„Wenn die genetische Information der DNA im Zellkern abgelesen wird, entsteht zunächst ein unreifer mRNA-Strang“, erklärt Fischer. Während des Reifungsprozesses setzen sich dann zahlreiche Proteine in unterschiedlichsten Kombinationen auf den Strang und leiten die jeweils notwendigen Schritte ein. Sie begleiten die mRNA während ihrer gesamten Lebenszeit und sorgen am Ende auch für deren Abbau. mRNP, oder messenger-Ribonukleoproteine heißen diese Verbindungen aus mRNA und assoziierten Proteinen; mit ihrer Vielfalt an Kombinationen bilden sie ein äußerst komplexes Netzwerk.
Extrem beengte Verhältnisse
Was die Forschung an diesem Netzwerk zusätzlich verkompliziert: „Diese Prozesse sind nie statisch. Vielmehr handelt es sich um eine äußerst dynamische Angelegenheit, die jedoch perfekt synchronisiert sein muss“, sagt Fischer. In der nur wenige Minuten bis maximal ein paar Stunden dauernden Lebenszeit eines mRNA-Strangs muss gewährleistet sein, dass die gesamte Zeit über exakt zum richtigen Zeitpunkt die dann notwendigen Proteine vor Ort und aktiv sind. Haben sie ihre Aufgaben erfüllt, müssen sie sich zurückziehen und anderen Akteuren die Bühne überlassen. „Wie das unter den extrem beengten Verhältnissen im Zellinneren funktionieren kann, ist kaum vorstellbar“, sagt der Biochemiker.
Natürlich ist es nicht so, dass in jedem Fall, wenn ein Gen abgelesen und eine Boten-RNA auf den Weg geschickt wird, 1.000 Entwicklungshelfer an dem Geschehen beteiligt sind. „Die Zusammensetzung variiert stark. In einer Muskelzelle sind ganz andere RNA-bindende Proteine im Einsatz als beispielsweise in einer Leberzelle“, so Fischer. Das Prinzip ist aber zellübergreifend gleich; RNA-bindende Proteine bilden die Grundlage für alle biochemischen Prozesse.
Neue Erkenntnisse für neue Impfstoffe
Dementsprechend breit einsetzbar sind die Erkenntnisse, die Fischer und seine Kollegen in den kommenden Jahren gewinnen wollen. Schließlich lassen sich daraus Schlüsse über die normale und die fehlerhafte Entwicklung von Organismen ziehen. Die Prozesse spielen eine Rolle bei Infektionen und bei der Entstehung von Tumoren. Und für die Entwicklung neuer Impfstoffe sind sie ebenfalls relevant.
„Wie sich in der Coronapandemie gezeigt hat, sind mRNAs von enormer Bedeutung für die Entwicklung neuer Vakzine“, erklärt Utz Fischer. Dabei sei das Verständnis von Sequenzelementen und mRNA- Modifikationen Voraussetzung für das Design von stabilen und planmäßig arbeitenden mRNAs. Aus diesem Grund werden die vier Forschungsgruppen nicht nur die Funktion RNA-bindender Proteine erforschen. Anliegen ihres Programms ist es auch, stabilisierende beziehungsweise destabilisierende RNA-Elemente und -Modifikationen zu identifizieren und zu testen.
1,6 Millionen Euro für fünf Jahre
Auf fünf Jahre ist das Forschungsprojekt Quantitative and mechanistic dissection of messenger RNA stability angelegt; dafür stehen den vier beteiligten Gruppen insgesamt 1,6 Millionen Euro zur Verfügung. Neben Utz Fischer sind daran beteiligt: Professor Gunter Meister, Institut für Biochemie, Genetik und Mikrobiologie der Uni Regensburg, sowie die Professoren und RNA-Experten Igor Ulitsky und Schraga Schwartz vom Weizmann Institut of Science in Israel.
Finanziert wird das Projekt aus Mitteln des Bundesministeriums für Bildung und Forschung (BMBF); die wissenschaftliche und administrative Verantwortung – und damit auch die Entscheidung über die Genehmigung – liegt in der Zuständigkeit der Deutschen Forschungsgemeinschaft DFG im Rahmen der Deutsch-Israelischen Projektkooperation (DIP). „Die Qualität der Forschungsarbeit und die Stärke der wissenschaftlichen Zusammenarbeit einschließlich des Austauschs von Wissenschaftlern, insbesondere von Nachwuchswissenschaftlern, sind die Hauptkriterien für die Begutachtung und Auswahl“, heißt es dazu auf der Homepage der DFG.
Kontakt
Prof. Dr. Utz Fischer, Lehrstuhl für Biochemie, T: (0931) 31-84029, utz.fischer@biozentrum.uni-wuerzburg.de
Homepage des Lehrstuhls für Biochemie