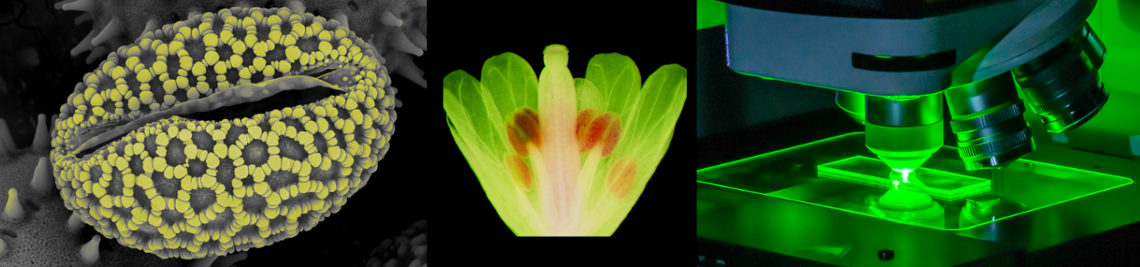
Säuresensor und Kalziumspeicher in Pflanzen entdeckt
15.12.2023Mittels Optogenetik haben Würzburger Forscher einen neuen Säuresensor in Pflanzenzellen nachgewiesen. Sie entdeckten zudem einen zellinternen Kalziumspeicher, wie sie im Journal „Science“ berichten.
Wenn Pflanzen von Krankheitserregern infiziert werden, an Wassermangel leiden oder auf andere äußere Reize reagieren müssen, erhöhen sie als erstes die Protonen- und Kalziumkonzentration in den betroffenen Zellen. Die Protonen und Kalziumionen wirken dann wie Botenstoffe, die in der Zelle weitere Reaktionen anstoßen.
Welche Wechselbeziehungen bei diesem Prozess zwischen Protonen und Kalziumionen herrschen, war bislang weitgehend unbekannt. Ein Artikel im Journal Science bringt nun Licht ins Dunkel; er stammt von einem Team um den Biophysiker Professor Rainer Hedrich von der Julius-Maximilians-Universität (JMU) Würzburg.
Die Forscher haben mit einem ausgeklügelten optogenetischen Ansatz einen bislang unbekannten endogenen Säure-Sensor in Pflanzenzellen entdeckt. Und sie haben herausgefunden, dass es in den Schließzellen der Blätter einen Kalziumspeicher gibt, der bei der Verarbeitung externer Signale eine wichtige Rolle spielt.
Warum so einfache Elemente wie Protonen und Kalziumionen als Signale wirken
Im Lauf der Evolution haben Zellen ihren Stoffwechsel auf die Nutzung energiereicher Phosphate ausgelegt. Daraus ergibt sich ein Problem: Beim vorwiegend neutralen zellulären pH-Wert können die wertvollen Phosphate durch Kalziumionen (Ca2+) gebunden und in eine unlösliche und damit nicht mehr nutzbare Form gebracht werden (Kalziumdihydrogenphosphat).
Um das zu vermeiden, halten Zellen ihren inneren Kalziumspiegel sehr niedrig; in ihrer Umgebung ist er dagegen 10.000 Mal größer. Außerhalb der Zellen ist auch die Konzentration von Protonen (H+) und damit der Säuregrad sehr viel höher. Durch dieses Konzentrationsgefälle haben beide Ionentypen einen starken Drang, in die Zellen hineinzuströmen – so bietet sich ihre Nutzung als Botenstoffe geradezu an.
„Durch die reizabhängige Öffnung von Kalzium- und Protonenkanälen in der Zellmembran kommt es zu einem zeitlich begrenzten innerzellulären Anstieg der beiden Boten-Ionen“, erklärt Rainer Hedrich. „Die Zellen verstehen das als Signal, das sie durch kalzium- und protonenbindende Enzyme in eine biologische Reaktion übersetzen.“
Lichtschalter steuert den Protonenfluss in die Zelle
Wie reagieren Pflanzenzellen auf den Einstrom von Protonen und die damit verbundene Ansäuerung ihres Zellplasmas? Das konnte bislang nur mit großem experimentellen Aufwand und selbst dann nur indirekt untersucht werden.
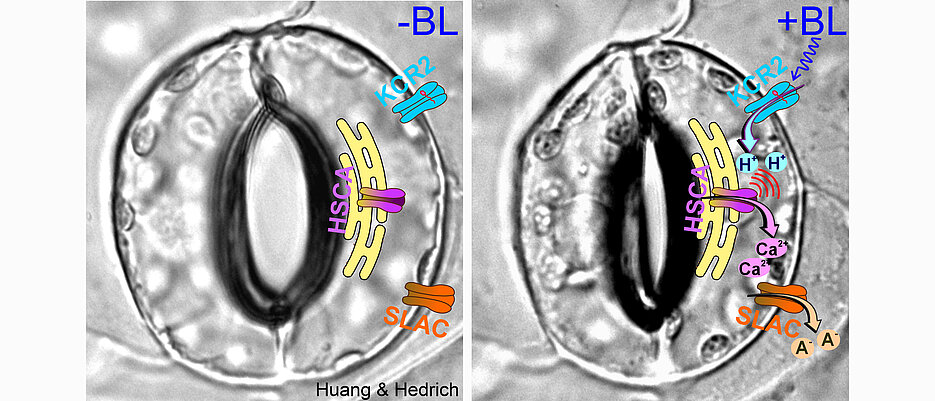
Deutlich einfacher geht das nun Dank einer entsprechend ausgestatteten Ackerschmalwand (Arabidopsis thaliana), die Hedrichs Team mit optogenetischen Methoden entwickelt hat: Dazu wurde ein lichtempfindlicher Protonenkanal aus einem Pilz, das Channelrhodopsin KCR2, für den Einsatz in Pflanzenzellen optimiert. So lassen sich nun auf einen Lichtimpuls hin gezielt Protonen in die Zellen schicken.
Darüber hinaus haben die Forscher das KCR2 Gen zusammen mit dem ‚pHuji‘-Gen exprimiert, einem genetisch kodierten pH-Reporter. Über diesen Reporter lässt sich sehr einfach messen, welcher aktuelle pH-Wert in der Zelle herrscht, wenn KCR2 aktiviert wird.
Shouguang Huang, der Erstautor der Science-Publikation, nahm als nächstes die Schließzellen der neuen Arabidopsis-Mutante unter die Lupe. „Als ich sie für eine Sekunde mit Blaulicht stimulierte, depolarisierten sie, so wie ich das von einem lichtaktivierten Protonenkanal erwartet hatte“, erzählt der Forscher. Bei den folgenden Experimenten machten die Würzburger Ionenkanal-Spezialisten eine weitreichende Entdeckung.
KCR2-Aktivierung säuert die Zelle an und lässt Kalzium ansteigen
Ihre elektrophysiologischen Studien an Schließzellen zeigten, dass mit Beginn der Lichtstimulation das Membranpotential augenblicklich depolarisierte und der pH-Reporter pHuji eine Ansäuerung des Zellinneren signalisierte.
„Wir staunten dann aber nicht schlecht, als nach dem Ende des Lichtpulses die Depolarisation und die Ansäuerung noch gut eine Minute anhielten“, so Hedrich. „Das konnte nur bedeuten, dass die Lichtaktivierung von KCR2 und die Ansäuerung schließzelleigene Ionenkanäle aktiviert hatten.“ Dabei handelt es sich um die lange bekannten Schließzellen-Anionenkanäle SLAC1 und SLAH3, für deren Aktivierung allerdings auch die Anwesenheit von Kalzium nötig ist.
Endoplasmatisches Retikulum als Kalziumspeicher
„Zählt man alle Fakten zusammen, war davon zu auszugehen, dass die von KCR2 getragenen Protonenströme und die damit verbundene Ansäuerung des Zellinneren zusätzlich ein Kalziumsignal erzeugt haben mussten“, resümiert der JMU-Professor.
Sein Team konnte nachweisen, dass auf die rasche Ansäuerung der Schließzellen ein 150 bis 200 Sekunden anhaltendes Kalziumsignal folgt. Und es fand heraus, dass dieses Kalzium nicht von außerhalb der Zelle stammt, sondern aus einem endogenen Speicher freigesetzt wird, dem Endoplasmatischen Retikulum. Das ist ein Netzwerk aus Membranröhren und -zisternen, die das Zellplasma durchziehen.
In zukünftigen Studien soll es nun darum gehen, die molekulare Natur des säuresensitiven Kalziumkanals des Endoplasmatischen Retikulums zu analysieren und seinen von Protonen betätigten An- und Aus-Schalter zu untersuchen. Insgesamt sind diese Studien wichtig, um besser zu verstehen, wie Pflanzenzellen auf äußere Reize wie Infektionen oder Dürre reagieren.
Publikation
Light-gated channelrhodopsin sparks proton-induced calcium release in guard cells. Shouguang Huang, Like Shen, M. Rob G. Roelfsema, Dirk Becker, Rainer Hedrich. Science, Datum: 15. Dezember 2023, DOI: 10.1126/science.adj9696
Kontakt
Prof. Dr. Rainer Hedrich, Lehrstuhl für Botanik I (Molekulare Pflanzenphysiologie und Biophysik), Universität Würzburg, T +49 931 31-86100, hedrich@botanik.uni-wuerzburg.de