Pädiatrische Nierentumoren und Wilms Tumor Genetik
Nierentumoren bilden die zweitgrößte Gruppe solider Tumoren im Kindesalter. Sie gehen vermutlich von fehldifferenzierten embryonalen Nieren-Vorläuferzellen aus. Für Wilms-Tumoren (auch Nephroblastome genannt) konnten wir Mutationen in einer Reihe von Genen als mögliche Auslöser identifizieren. Wir versuchen den Wirkmechanismus dieser Tumorgene durch in vitro Experimente und mit Hilfe von Mausmodellen genauer zu verstehen, um eine gezieltere Diagnostik zu ermöglichen und neue Angriffspunkte für verbesserte Therapien zu finden.
Hierzu etablieren wir Zellkulturen dieser Tumoren und vergleichen die Funktion normaler und mutierter Genkopien. Mittels Hochdurchsatzmethoden fahnden wir nach Unterschieden in der Genaktivität und im biologischen Verhalten der veränderten Proteine.
WT1 (Wilms-Tumorsuppressorgen 1) ist das erste von uns entdeckte Tumorsuppressorgen, das eine Rolle bei der Entstehung von Wilms Tumoren spielt. Das WT1-Protein ist ein Transkriptionsfaktor, der wichtige Prozesse u.a. in der embryonalen Nierenentwicklung steuert. Bei ca. 15% aller Wilms Tumore kann eine Mutation bzw. einen Verlust von WT1 nachgewiesen werden.
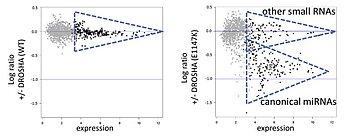
DROSHA und DGCR8 bilden zusammen den sogenannten Mikroprozessorkomplex, der eine wichtige Rolle in der miRNA Biogenese spielt.
Wir konnten somatische Hotspot Mutationen in diesen Genen identifizieren, die vor allem in blastemreichen Wilms Tumoren auftreten. Funktionelle Analysen in Zellen zeigten, dass Defekte in diesen Genen zu einer bedeutenden Abnahme an kanonischen miRNAs führt, was ihre Relevanz in der korrekten Prozessierung von miRNAs unterstreicht. Es ist bereits bekannt, dass miRNAs eine wichtige Funktion in pädiatrischen Tumoren besitzen, weshalb wir verstärkt daran interessiert sind, die Mutationen in DROSHA und DGCR8 als mögliche onkogene Treiber in Wilms Tumoren weiter zu erforschen.
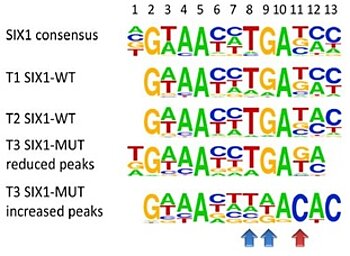
SIX1 (SIX homeobox 1) und SIX2 sind Transkriptionsfaktoren aus der SIX Protein-Familie, die eine wichtige Rolle während der embryonalen Nierenentwicklung spielen. Sie sind nötig um mesenchymale Vorläuferzellen zu erhalten, aus denen sich die funktionellen Nierenuntereinheiten entwickeln. Der Verlust eines dieser Gene führt bei Mäusen zu Nierenagenesie oder verringerter Organgröße. Andererseits erlaubt die Überexpression von Six1 und Six2 zusammen mit weiteren Genen die Reprogrammierung adulter Tubulizellen zu Nierenvorläuferzellen.
In blastemreichen Wilms Tumoren fanden wir wiederkehrende Mutationen in der DNA-Bindungsdomäne von SIX1 und SIX2. Anhand von Mausmodellen wollen wir nun die Auswirkungen dieser SIX-Mutationen besser verstehen.
N-Myc ist ein Proto-Onkogen und gehört zur Familie der MYC-Proteine, einer Gruppe von bHLH-Transkriptionsfaktoren, die eine wichtige Rolle in vielen zellulären Prozessen spielen.
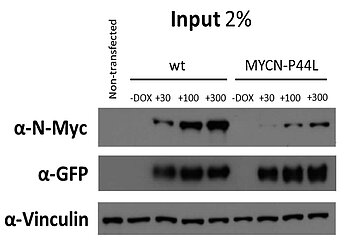
Eine Überexpression und Amplifikation von MYCN wurde zunächst im Neuroblastom beschrieben, ist aber inzwischen für viele Tumoren bekannt. In Wilms Tumoren sind sowohl die genomische Amplifikation, als auch eine Überexpression von MYCN mit einer schlechten Prognose korreliert. Neben der MYCN-Amplifikation wird gelegentlich auch eine Punktmutation (Pro44Leu) in WT gefunden. Um die funktionelle Bedeutung dieser Mutation und einer MYCN-Amplifikation zu charakterisieren, untersuchen wir MYCN und dessen Interaktionspartner MAX in-vitro (in primären WT-Zellen) und in-vivo (Mausmodel).
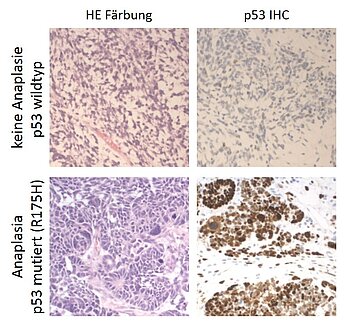
p53 wird auch als „Wächter des Genoms“ bezeichnet und spielt eine wichtige Rolle für die Genomstabilität, indem es Zellen mit DNA-Schäden an der Zellteilung hindert. p53-Mutationen finden wir hauptsächlich in anaplastischen Wilms Tumoren, die zur Hochrisikogruppe dieses Tumors gehören. Wir untersuchen derzeit, ob p53-Mutationen auch außerhalb dieser Untergruppe auftreten und dort eine prognostische Bedeutung haben.