Bone morphogenetic proteins
Bone Morphogenetic Proteins (BMPs) als Faktoren der Knochen- und Gewebehomöostase
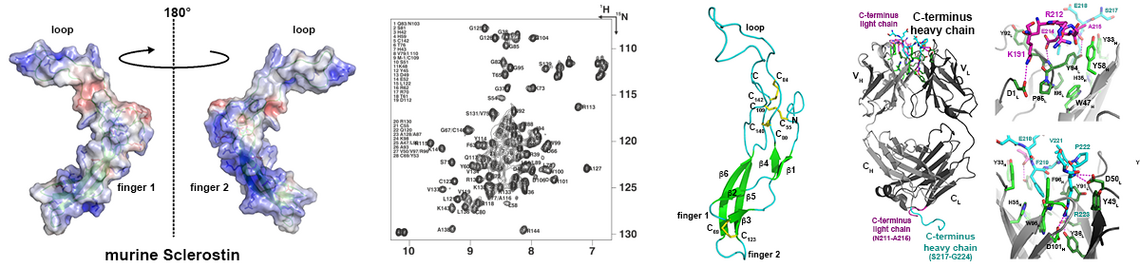
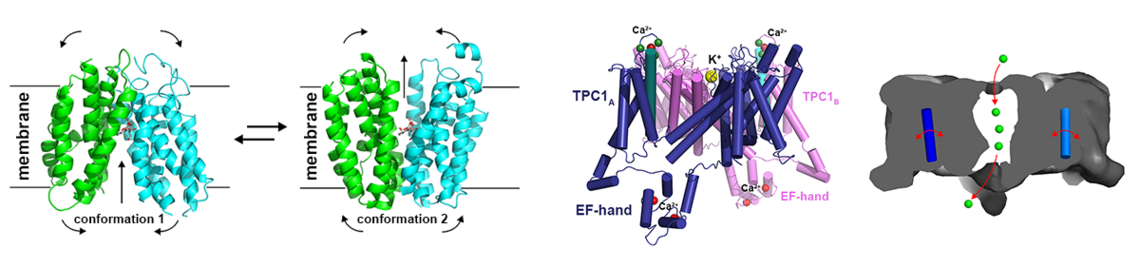
Die von Marshall Urist erstmals 1965 aus Knochenmaterial extrahierten Bone Morphogenetic Proteins (BMPs) markieren gewissermaßen den Beginn der modernen Regenerativen Medizin, die heute auch mit dem Begriff Tissue Engineering assoziiert wird. Entsprechend ihrem Namen führt eine Implantation dieser Proteine in Muskelgewebe dort zur Bildung von ektopem Knochen. Diese Fähigkeit wird heute therapeutisch bei der Behandlung nicht selbst-heilender Knochenfrakturen oder zur Fusion einzelner Wirbel der Wirbelsäule bei degenerativen Bandscheibenerkrankungen angewendet. Inzwischen sind mehr als 30 Vertreter der Transforming Growth Factor (TGF)β Familie bekannt, in welcher die BMPs die größte Untergruppe bilden. Die Wachstumsfaktoren aktivieren ihren Rezeptor, indem sie zwei unterschiedliche, als Typ I und Typ II Rezeptoren bezeichnete, Klassen von Serin-/Threoninkinase-Transmembranrezeptoren in einen heteromeren Komplex assemblieren. Diese Komplexbildung führt im Zytoplasma anschließend zur Aktivierung verschiedener Signalwege, beispielsweise der SMAD oder der MAP Kinase Signalkaskade.
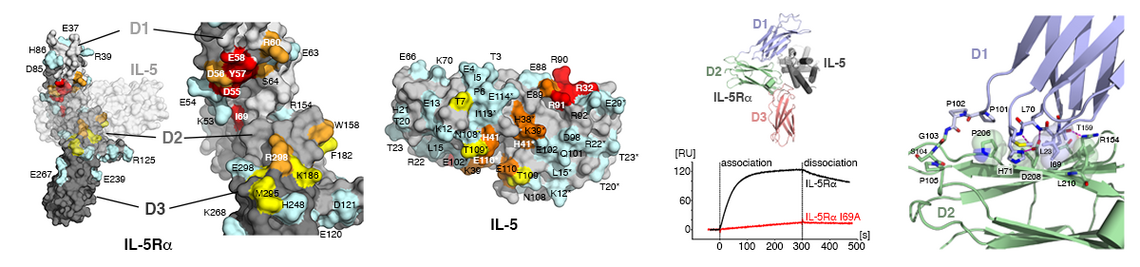
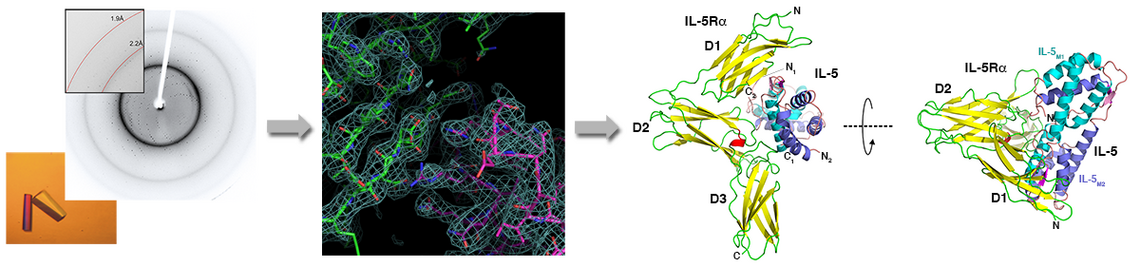
Interessanterweise stehen für die mehr als 30 Wachstumsfaktoren lediglich 12 Rezeptoren, fünf Typ I und sieben Typ II Rezeptoren, zur Verfügung. Daher können die Rezeptoren oft mehrere Wachstumsfaktoren binden, ebenso ist bekannt, dass viele der TGFβ Faktoren auch mehrere Rezeptoren beider Subklassen binden und aktivieren. Dies wirft die Frage auf, wie die TGFb Proteine trotz dieser beobachteten Rezeptor-Promiskuität ein Faktor-spezifisches Signal in die Zelle übermitteln können. Auf molekularer Ebene stellt sich wiederum die Frage, wie die Bindestellen dieser Faktoren strukturell beschaffen sein müssen, um verschiedene Rezeptoren gleichermaßen spezifisch/unspezifisch binden zu können.
Durch zahlreiche Strukturanalysen konnten wir die Mechanismen aufklären (z.B. 1-3; für Übersichtsartikel siehe: 1-6), die eine derartige promiske Protein-Protein Interaktion ermöglichen. Mit der so erhaltenen Kenntnis lassen sich nun mittels Protein Design gezielt TGFb/BMP Proteine entwickeln, die spezifisch bestimmte Rezeptoren binden und aktivieren. Da viele der Rezeptoren Zelltyp-spezifisch expremiert werden, können so in diesen Proteinvarianten (Designer-BMPs) spezifische Funktionen kodiert werden. Solche neuartigen BMPs mit definierten Funktionen stellen interessante Ansatzpunkte für therapeutische Anwendungen beispielsweise in der Behandlung von degenerativen Knochen- oder Knorpelerkrankungen dar.
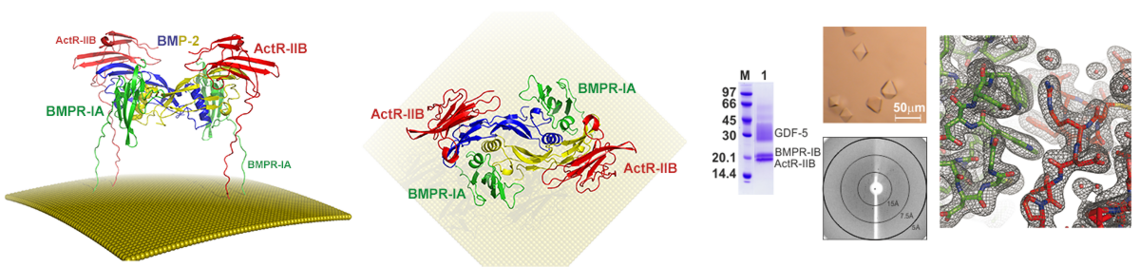
- Klammert U, Mueller TD, Hellmann TV, Wuerzler KK, Kotzsch A, Schliermann A, Schmitz W, Kuebler AC, Sebald W, Nickel J: GDF-5 can act as a context-dependent BMP-2 antagonist. BMC Biol 2015, 13:77.
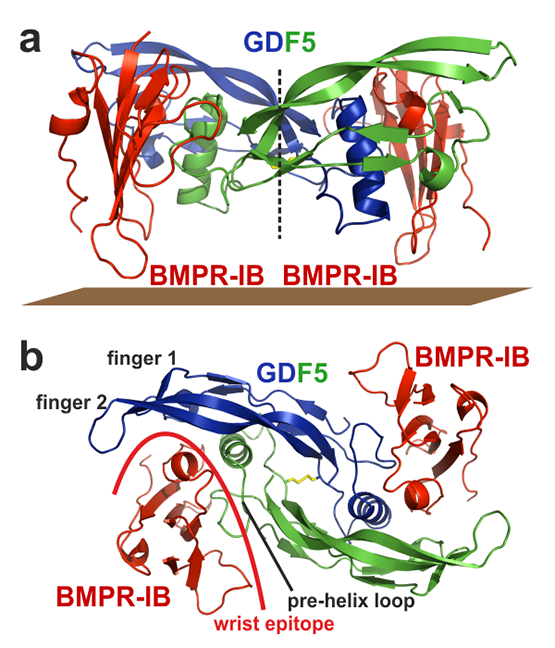
- Kotzsch A, Nickel J, Seher A, Sebald W, Muller TD: Crystal structure analysis reveals a spring-loaded latch as molecular mechanism for GDF-5-type I receptor specificity. EMBO J 2009, 28(7):937-947.
- Kotzsch A, Nickel J, Seher A, Heinecke K, van Geersdaele L, Herrmann T, Sebald W, Mueller TD: Structure analysis of bone morphogenetic protein-2 type I receptor complexes reveals a mechanism of receptor inactivation in juvenile polyposis syndrome. J Biol Chem 2008, 283(9):5876-5887.
- Yadin D, Knaus P, Mueller TD: Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine Growth Factor Rev 2016, 27:13-34.
- Hinck AP, Mueller TD, Springer TA: Structural Biology and Evolution of the TGF-beta Family. Cold Spring Harb Perspect Biol 2016, 8(12).
- Mueller TD: Mechanisms of BMP-Receptor Interaction and Activation. Vitam Horm 2015, 99:1-61.