Wie Pockenviren sich vermehren
23.09.2021Pockenviren haben einen einzigartigen Weg gefunden, ihre Gene im infizierten Organismus in Proteine zu übersetzen. Ein Würzburger Forschungsteam zeigt erstmals die atomare Arbeitsweise der daran beteiligten molekularen Maschinen.
Der weltweit letzte Pockenfall trat im Oktober 1977 in Somalia auf. 1980 hat die Weltgesundheitsorganisation WHO die Pocken für ausgerottet erklärt. Offiziellen Angaben nach existiert das Virus heute nur noch in zwei Hochsicherheitslaboren in Russland und in den USA und dient dort Forschungszwecken.
Auch wenn es deshalb aktuell keine unmittelbare Bedrohung mehr für den Menschen durch Pockenviren gibt, ist diese Virusfamilie für Forscher nach wie vor von großem Interesse. Zum einen werden modifizierte Stämme erfolgreich bei der Behandlung von Krebserkrankungen eingesetzt, zum anderen faszinieren ihre ungewöhnlichen Vermehrungseigenschaften.
Pockenviren bauen ihre eigene Vermehrungsmaschine
Während sich viele Viren in großem Umfang der biochemischen Ausstattung der Wirtszelle bedienen, um sich zu vermehren, kodieren Pockenviren eine eigene molekulare Maschinerie dafür in ihrem Genom. Wichtige Bestandteile dieser Maschinerie sind zwei Enzyme, die DNA-Polymerase, die die viralen Gene vervielfältigt, und die RNA-Polymerase, die die viralen Gene in mRNA umschreibt. Die RNA-Polymerase des Pockenvirenstammes Vaccinia beispielsweise ist ein großer Komplex, der 15 verschiedene Proteinuntereinheiten mit unterschiedlichen biochemischen Funktionen zusammenfasst.
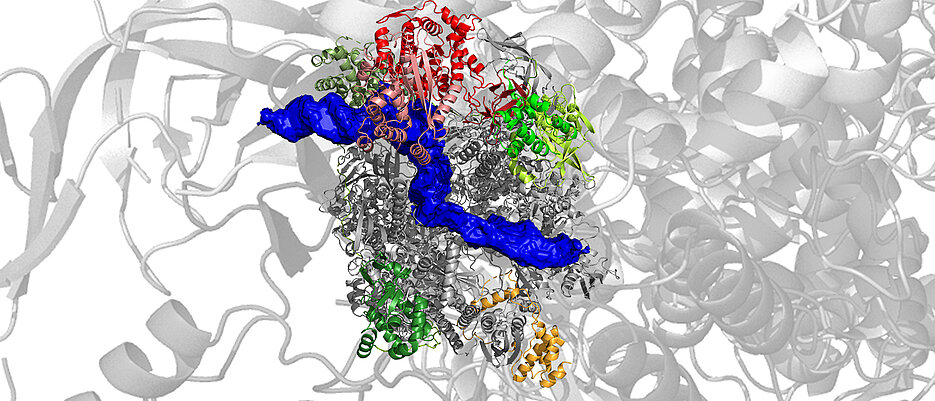
Einem Forschungsteam vom Biozentrum der Julius-Maximilians-Universität Würzburg (JMU) ist es jetzt erstmals gelungen, der Polymerase von Vaccinia-Viren auf atomarer Ebene bei der Arbeit zuzusehen. Zuvor hatte es bereits in seinen Experimenten die RNA-Polymerase in atomarer Auflösung dargestellt. Verantwortlich für die Arbeiten ist die Gruppe um Utz Fischer, dem Inhaber des Lehrstuhls für Biochemie I der JMU. In einer Veröffentlichung in der Fachzeitschrift Nature Structure and Molecular Biology stellt die Gruppe jetzt die Ergebnisse seiner Arbeit vor.
Dreidimensionale Strukturen in atomarer Größenordnung
„Wir haben isolierte RNA-Polymerase mit einem Stück DNA gemischt, das das Startsignal für die Transkription viraler Gene, den Promoter, enthält. Das Enzym erkannte präzise dieses DNA-Element, und fing an mRNA herzustellen“, erläutert Julia Bartuli, die für die biochemische Arbeit der Studie verantwortlich ist. Anschließend wurden die Proben in Zusammenarbeit mit Bettina Böttcher vom Lehrstuhl für Biochemie II im Kryo-Elektronenmikroskop untersucht. Auf Basis der dabei gesammelten Daten konnten die Wissenschaftlerinnen und Wissenschaftler die dreidimensionale Struktur der Probe bis in die Größenordnung von Atomen unter Einsatz moderner Computerverfahren rekonstruieren.
Von dem Endergebnis dieses langwierigen Prozesses waren sie begeistert: „Wir haben zwar nur eine Probe im Mikroskop untersucht, aus dieser konnten wir aber insgesamt sechs unterschiedliche Polymerase-Komplexe rekonstruieren, die wir schließlich einzelnen Phasen des Transkriptionsprozesses zuordnen konnten“, erklärt Clemens Grimm, der an Fischers Lehrstuhl für die Strukturanalyse verantwortlich ist. „Diese Einzelaufnahmen erlauben uns, sie wie in einem Film aneinanderzureihen und so die frühe Phase der Transkription auch zeitaufgelöst darzustellen.“ (siehe Links am Ende des Textes).
Pocken sind weiterhin eine Bedrohung für den Menschen
Aber warum sollte man über Pockenviren forschen, wenn das für Menschen so gefährliche Virus doch bereits ausgerottet wurde? Hierfür gibt es gute Gründe, wie Fischer entgegnet: „Eine Pockeninfektion ist nach wie vor nicht zuverlässig heilbar, sondern nur durch eine Impfung zu verhindern. Sollten bislang noch vorhandene Virusproben, beispielsweise durch einen terroristischen Anschlag, wieder verbreitet werden, würden sie auf eine Bevölkerung treffen, die keinen Impfschutz hat.“
Eine weitere, möglicherweise realere Bedrohung sind Zoonosen, bei denen bislang tierspezifische Viren auf den Menschen überspringen, erklärt Fischer. So komme es sporadisch immer wieder zu Infektionen des Menschen durch Affen-Pockenviren, die bei den Betroffenen ein schweres Krankheitsbild hervorrufen können. „Sollte eine solche Zoonose durch weitere Anpassungen an den menschlichen Wirt und eine Mensch-zu-Mensch-Übertragung Fahrt aufnehmen, könnte eine gefährliche Epidemie entstehen“, so der Biochemiker.
Mit dem Computer zu neuen Medikamenten
Wirkstoffe, welche die Genexpression der Viren hemmen, wären als antivirale Medikamente daher von großer Relevanz. Das Wissen über die atomaren Strukturen der RNA-Polymerase in ihren verschiedenen Zuständen erlaubt es den Forschern nun, die Entwicklung solcher Hemmstoffe über einen rationalen, strukturbasierten Ansatz im Computer anzugehen. Derartige Studien, die sich in ihrer Herangehensweise grundlegend von der klassischen, versuchsbasierten Methode unterscheiden, sind bereits in vollem Gange.
Originalpublikation
Structural basis of the complete poxvirus transcription initiation process. Clemens Grimm, Julia Bartuli, Bettina Boettcher, Aladar A. Szalay and Utz Fischer. Nature Structure and Molecular Biology. https://www.nature.com/articles/s41594-021-00655-w
Kontakt
Prof. Dr. Utz Fischer, Lehrstuhl für Biochemie, Julius-Maximilians-Universität Würzburg, T: +49 931 31-84029, utz.fischer@biozentrum.uni-wuerzburg.de
Stichwort Pockenviren
Vor 1976 Geborene tragen – zumindest in Deutschland – auf ihrem Oberarm die deutlich sichtbare Narbe der Pockenschutzimpfung. Bis dahin galt in Deutschland eine Impfpflicht. Diese Impfung ist einer der größten Erfolge des modernen Infektionsschutzes: Sie führte zur Ausrottung des tödlichen Pockenerregers. Dieser, wissenschaftlich bekannt als Variolavirus, hatte bis weit ins 20. Jahrhundert hinein die Menschheit regelmäßig in Form von Pockenepidemien heimgesucht und viele Millionen Menschen das Leben gekostet.
Frühe Formen einer Art „Impfung“ sind schon aus dem Altertum bekannt. Damals legten sich Menschen den Schorf abgeheilter Pocken in eine kleine Wunde und hofften, so einer ernsthaften Erkrankung vorbeugen zu können. In Europa wurden im 18. Jahrhundert derartige „Variolationen“ unter anderem auch am Würzburger Juliusspital durchgeführt. Der Durchbruch im Kampf gegen die Pocken gelang im Jahr 1796 dem Briten Edward Jenner, indem er das gefährliche Pockenvirus durch den für Menschen wesentlich harmloseren Erreger der Pferde- oder Kuhpocken ersetzte.
Der von Jenner verwendete Stamm ist unter dem Namen Vaccinia in die Medizingeschichte eingegangen. Er ist der Namensgeber für die heute gebräuchlichen Impfpraktiken, die medizinisch als Vakzinationen bekannt sind. Die weltweite Impfkampagne mit dem Vaccinia-Stamm führte schließlich dazu, dass die WHO 1980 zum ersten und bisher einzigen Mal in der Geschichte der Menschheit die globale Ausrottung einer Infektionskrankheit erklären konnte.
Links
Video „Animation der Umlagerung“. Es zeigt die Umlagerung von complete vRNAP zum Prä-Initiationskomplex und benutzt die zwei experimentellen Strukturen der complete vRNAP und des Prä-Initiationskomplex als Start- und Endzustand. Die sogenannte Trajektorie zeigt theoretisch errechnete Zwischenzustände, die die Überführung der beiden Komplexe ineinander veranschaulicht.
Video „Initiale Transkription“. Zu sehen sind Prozesse rund um den Transkriptionsbeginn am Promotor und Promotor-Escape. Das Video animiert die Vorgänge nach erfolgreicher Prä-Initiation. Der späte PIC (lPIC) fädelt den Einzelstrang in die aktive Furche ein. Während der initialen Transkription ('initial transcription' durch den ITC) wird die Transkriptionsstartstelle (transcription start site, TSS) gesucht. Die endgültige Loslösung vom Promoter (promoter escape) erfordert Energie, die die Helikase NPH-I ATP-abhängig bereitstellt. Durch einen bislang einzigartigen Mechanismus des sogenannten 'promoter scrunching' wird stromaufwärts einzelsträngige DNA in die Polymerase eingespult und ein energiegeladener Übergangszustand erzeugt (late ITC).