Verbesserte optogenetische Werkzeuge
Verbesserte optogenetische Werkzeuge: Charakterisierung neuer Rhodopsine und Engineering von neuartigen Merkmalen in bestehende Photorezeptoren (gefördert über TR166 bis Juni 2019)
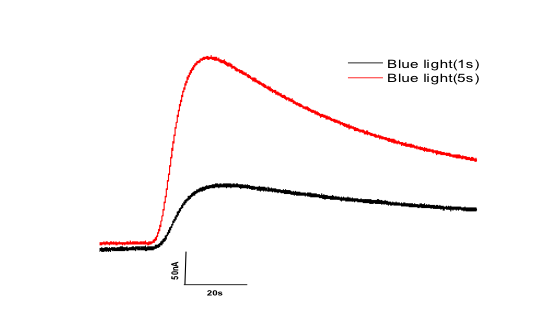
Der Durchbruch für "optogenetische Aktuatoren" kam mit der Entdeckung von Kanalrhodopsin-2 (Channelrhodopsin-2 = ChR2), einem direkt beleuchteten Kationenkanal, der in der Lage ist, Zellen zu depolarisieren und das Verhalten von transgenen Tieren zu modulieren. Der Erfolg von Channelrhodopsin-2 ermutigte uns, Halorhodopsin (HR) als hyperpolarisierendes und "Neuron-hemmendes" optogenetisches Protein einzuführen. HR, wie auch ChR2, haben jedoch gewisse Einschränkungen aufgrund ihres relativ geringen Ladungstransfers pro Proteinmolekül und ihres Bedarfs nach hoher Lichtintensität und hoher Proteinexpression. In 2014 haben wir eine ChR2-Mutante mit verbesserter Expression und dramatisch erhöhten Photoströmen eingeführt, auch bei geringer Lichtintensität (ChR2/XXL, Dawydow et al., 2014, PNAS). In diesem Projekt wollen wir weitere neue und verbesserte optogenetische Aktuatoren mit größerem Ladungstransfer pro Molekül und geringerem Lichtintensitätsbedarf entwickeln, basierend auf dem Engineering von etablierten optogenetischen Werkzeugen und der Charakterisierung neuer Photorezeptoren. Wir verbinden zyklische Nukleotid-gesteuerte (CNG) Kation- oder CNG-Kalium- (CNGK-) Kanäle mit Licht-aktivierten Adenylyl- oder Guanylycyclasen. Im Vergleich zu Kanalrhodopsin zeigen diese Kanäle eine höhere Einzelkanal-Leitfähigkeit. Sobald es lichtempfindlich gemacht wurde, wird dann auch eine spärliche Expression (verglichen mit ChR2 und HR) eine lichtaktivierte De- (CNG) oder Hyper- (CNGK) Polarisation ermöglichen. Zu diesem Zweck werden wir mit verschiedenen photoaktivierten Cyclasen arbeiten, die wir in den letzten Jahren in unserem Labor charakterisiert haben, siehe Projekt Licht-aktivierte Cyclasen: PAC & Cyclop.