Laubmoos als Pionier des Wassersparens
03/24/2015Wann in der Evolution haben Pflanzen gelernt, Wasser zu sparen? Die ersten Ansätze dazu fand ein internationales Forschungsteam bei einem Laubmoos. Dabei kam auch heraus, wie die Evolution mit Molekülen spielt.

Die ersten Pflanzen, die sich vor 500 Millionen Jahren aus dem Meer ans Land wagten, waren Grünalgen. Sie mussten damit zurechtkommen, dass sie nicht mehr ständig von Wasser umgeben waren. Das bedeutete für sie die große Gefahr, bei Trockenheit langsam zu verdorren.
Eine spätere Generation der Landpflanzen, die Moose, löste dieses Problem ganz geschickt: Bei Wassermangel trocknen sie zwar langsam aus, doch sobald sie wieder mit Wasser in Berührung kommen, springt ihre Photosynthese an und sie wachsen weiter. Die Moose schaffen das, weil sie sich bei der Evolution des Landgangs eine Austrocknungstoleranz zugelegt haben.
Enzym OST1 mit zentraler Funktion
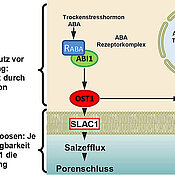
Moose produzieren, wie auch alle anderen Pflanzen, bei Wassermangel das Stresshormon Abscisinsäure (ABA). Das wiederum kurbelt die Produktion spezieller Austrocknungsschutz-Proteine an, der Dehydrine. Diese sorgen dafür, dass die Moose eine Trockenzeit ohne größeren Funktionsverlust überstehen. Für die Produktion der Dehydrine ist unter anderem das Enzym OST1 besonders wichtig.
Dieses Enzym sorgt auch bei höher entwickelten Pflanzen dafür, dass ein zu großer Wasserverlust vermieden wird. Allerdings tut es das hier nicht nur über Austrocknungsschutz-Proteine, sondern über einen zweiten Weg: Es aktiviert den Anionenkanal SLAC1 der Schließzellen in der Haut der Pflanzen. Daraufhin machen die Schließzellen die Poren dicht, über die das lebensnotwendige Kohlendioxid in die Pflanze strömt, über die aber auch Wasser an die Umgebung verloren geht.
Wann gab es erstmals Schließzellen in der Evolution? Die ersten landgängigen Algen und auch die relativ einfach gebauten Lebermoose besitzen noch keine. Erst bei den höher entwickelten Laubmoosen treten Schließzellen auf, wenn auch noch spärlich: Sie finden sich nur an einer stecknadelkopfartigen Struktur, mit der das Moos seine Sporen verbreitet.
Ergebnisse in „Current Biology“ publiziert
Wann in der Evolution haben die Pflanzen gelernt, über das Enzym OST1 die Produktion von Dehydrinen zu steuern? Und wann begannen sie, mit diesem Enzym den Anionenkanal der Schließzellen zu aktivieren? Diese Fragen haben die Würzburger Pflanzenwissenschaftler Dietmar Geiger und Rainer Hedrich mit Fachkollegen aus Freiburg, Madrid, Riad, Uppsala, Kyoto und West Lafayette beantwortet. Ihre Ergebnisse sind im Fachblatt „Current Biology“ veröffentlicht.
Die Forscher verglichen OST1-Enzyme und SLAC1-Kanäle aus vier verschieden hoch entwickelten Pflanzen: Sie untersuchten die Landalge Klebsormidium nitens, das Brunnen-Lebermoos Marchantia polymorpha, das Laubmoos Physcomitrella patens (Kleines Blasenmützenmoos) und Arabidopsis thaliana (Ackerschmalwand) als Vertreterin der höher entwickelten Pflanzen.
Struktur des Anionenkanals gab den Ausschlag
Dabei kam heraus, dass sich alle OST1-Varianten in ihrer Gensequenz nicht stark unterscheiden und dass sie alle die Produktion von Dehydrinen ankurbeln können. Ebenso können alle OST1-Varianten den Anionenkanal der Ackerschmalwand aktivieren. Dagegen versagten sie bei den Kanälen der Alge und des Lebermooses. Der Schlüssel zum Wassersparen muss also in der Struktur des Kanals liegen.
Bei dem untersuchten Laubmoos, das entwicklungsgeschichtlich jünger ist als das Lebermoos, fanden die Wissenschaftler eine Besonderheit: Es besitzt zwei Formen des Anionenkanals, und eine davon reagiert bereits auf OST1 – das allerdings ganz schwach. Baut man den zweiten, völlig inaktiven Kanal nach dem Vorbild der OST1-empfindlichen Kanäle um, gewinnt er zunehmend an Aktivität.
Damit hat das Forschungsteam gezeigt, dass OST1 schon sehr früh in der Evolution so weit ausgereift war, dass es die Dehydrin-Produktion steuern kann. Dagegen erwarb der Kanal SLAC1 die Fähigkeit, auf OST1 zu reagieren, erst mit der Entstehung der Laubmoose. „Die Evolution hat mit der Struktur des Kanals und mit dessen Funktion solange gespielt, bis er vom bereits bestehenden ABA-Dehydrin-Signalweg angesteuert werden und die Aufgabe als Wasserspartaste übernehmen konnte“, so Hedrich.
Suche nach weiterer evolutionärer Spielwiese
Ist die Frage nach der Evolution des Wassersparens damit beantwortet? Noch nicht, meint der Würzburger Professor: „Die Schließzellen der Moose und der später folgenden Farne reagieren nicht oder nur schwach auf das Wasserstresshormon ABA. Deshalb bleibt noch zu prüfen, wann sich auf dem Weg zur hoch entwickelten Blütenpflanze alle funktionellen Komponenten des ABA-abhängigen Signalwegs in den Schließzellen zusammengefunden haben. Die Spielwiese für die Optimierung dieses Wegs vermuten wir beim Übergang von den Farnen zu frühen Blütenpflanzen.“
Stomatal Guard Cells Co-opted an Ancient ABA-Dependent Desiccation Survival System to Regulate Stomatal Closure, Christof Lind, Ingo Dreyer, Enrique J. López-Sanjurjo, Katharina von Meyer, Kimitsune Ishizaki, Takayuki Kohchi, Daniel Lang, Yang Zhao, Ines Kreuzer, Khaled A.S. Al-Rasheid, Hans Ronne, Ralf Reski, Jian-Kang Zhu, Dietmar Geiger and Rainer Hedrich, Current Biology, online publiziert am 19. März 2015,
www.cell.com/current-biology/abstract/S0960-9822%2815%2900131-1
Kontakt
Prof. Dr. Rainer Hedrich, Lehrstuhl für Botanik I (Pflanzenphysiologie und Biophysik), Universität Würzburg, T (0931) 31-86100, hedrich@botanik.uni-wuerzburg.de