Ionenkanäle
Molekulare Mechanismen des Ionentransports pflanzlicher Ionenkanäle
Ionenkanäle haben zahlreiche essentielle Zellfunktionen sowohl in tierischen wie auch pflanzlichen Zellen. Sie sind verantwortlich für die Aufrechterhaltung der Ionenhomöostase, der Regulation des Zellvolumens und des Turgors, sie regulieren den zellulären Säure-Base Haushalt, steuern inter- und intrazelluläre Transportvorgänge und bilden mit der Einstellung des Membranpotentials die Grundlage für die elektrische Erregbarkeit von Zellen. Die Isolierung der Zellen voneinander durch Abgrenzung mittels einer hydrophoben Membran kann erst durch Einbau solcher porenbildender Transmembranproteine für einen Austausch elektrisch geladener Ionen permeabel gemacht werden. Die Kontrolle des Ionenflusses als auch der Art des Ions erfordern die Anwesenheit verschiedener Architekturmerkmale in dem Transmembranprotein, wie z.B. ein steuerbares Ventil (gate), einen Selektivitätsfilter, sowie zusätzliche Domänen oder Module, welche es ermöglichen die Eigenschaften des Ventils und möglicherweise des Selektivitätsfilters zu verändern. Besondere Schwierigkeiten bei der rekombinanten Herstellung als auch der Strukturaufklärung von Transmembranproteinen haben dazu geführt, dass unsere Kenntnisse über molekulare Transport- und Steuermechanismen trotz aller Fortschritte in den letzten 10 Jahren immer noch sehr limitiert sind.
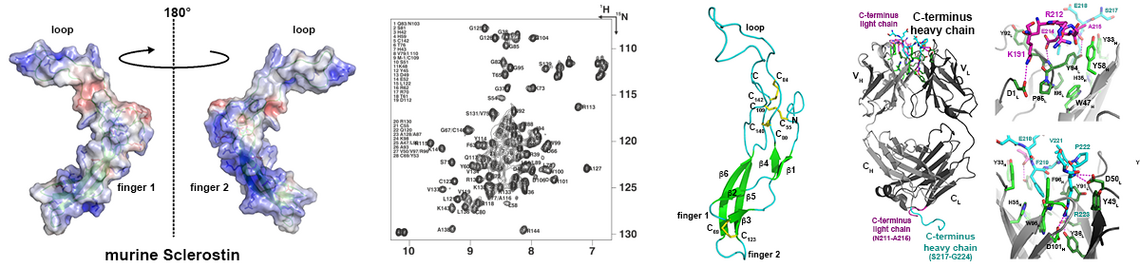
Unsere Gruppe arbeitet derzeit an der experimentellen Strukturaufklärung mehrerer Vertreter der SLAC/SLAH Anionenkanalfamilie (1). Diese Anionenkanäle spielen eine wesentliche Rolle bei der Steuerung der Stomatabewegung und sind für Regulation des Wasserverlusts in Pflanzen durch Transpiration von großer Bedeutung. Die rekombinante Herstellung integraler Membranproteine ist auch noch heute ein schwieriges Unterfangen, welches die Entwicklung neuer Expressions- und Aufreinigungsverfahren notwendig macht. Die rekombinanten Membranproteine sollen dann kristallisiert und die Proteinkristalle mittels Röntgenbeugung analysiert werden. Alternativ haben Fortschritte in der technischen Entwicklung der Cryo-Elektronenmikroskopie in den letzten fünf Jahren dazu geführt, dass auch diese Methodik unter bestimmten Voraussetzungen hochaufgelöste Strukturdaten bereitstellen kann. Da hier eine Kristallisation des Membranproteins nicht notwendig ist, können auch Proteine untersucht werden deren Kristallisation trotz aufwendiger Optimierungsversuche bisher fehlgeschlagen ist.
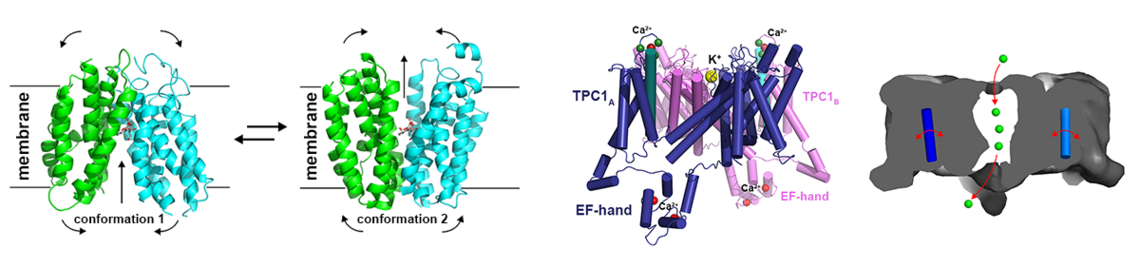
Für Ionenkanalvertreter, für die bereits Strukturen homologer Membranproteine existieren, werden mittels Homologiemodellierung und Moleküldynamiksimulationen 3D Modelle erstellt (2-6). Diese ermöglichen dann Vorhersagen zur Ionenselektivität des Kanals und möglichen Aktivierungsmechanismen. Diese Aussagen müssen anschließend durch Mutagenesestudien und zellbiologische und biophysikalische Analysen überprüft werden. Anhand solcher in silico Simulationen konnten wir die Regulation des Ionentransports verschiedener Kationenkanäle molekular beschreiben (2-6).
- Maierhofer T, Lind C, Huttl S, Scherzer S, Papenfuss M, Simon J, Al-Rasheid KA, Ache P, Rennenberg H, Hedrich R et al: A Single-Pore Residue Renders the Arabidopsis Root Anion Channel SLAH2 Highly Nitrate Selective. Plant Cell 2014, 26(6):2554-2567.
- Bohm J, Scherzer S, Shabala S, Krol E, Neher E, Mueller TD, Hedrich R: Venus Flytrap HKT1-Type Channel Provides for Prey Sodium Uptake into Carnivorous Plant Without Conflicting with Electrical Excitability. Mol Plant 2015.
- Scherzer S, Krol E, Kreuzer I, Kruse J, Karl F, von Ruden M, Escalante-Perez M, Muller T, Rennenberg H, Al-Rasheid KA et al: The Dionaea muscipula Ammonium Channel DmAMT1 Provides NH4(+) Uptake Associated with Venus Flytrap's Prey Digestion. Curr Biol 2013, 23(17):1649-1657.
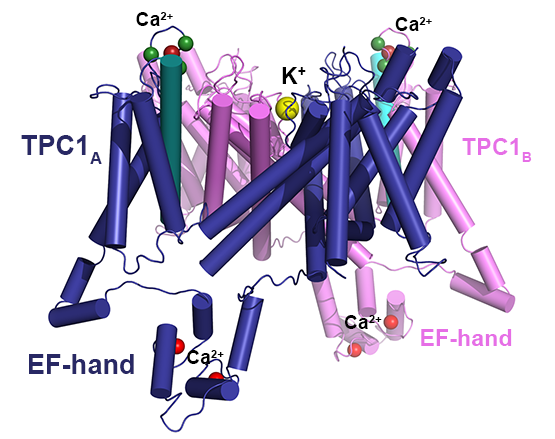
- Dadacz-Narloch B, Beyhl D, Larisch C, Lopez-Sanjurjo EJ, Reski R, Kuchitsu K, Muller TD, Becker D, Schonknecht G, Hedrich R: A novel calcium binding site in the slow vacuolar cation channel TPC1 senses luminal calcium levels. Plant Cell 2011, 23(7):2696-2707.
- Dunkel M, Latz A, Schumacher K, Muller T, Becker D, Hedrich R: Targeting of vacuolar membrane localized members of the TPK channel family. Mol Plant 2008, 1(6):938-949.
- Latz A, Becker D, Hekman M, Muller T, Beyhl D, Marten I, Eing C, Fischer A, Dunkel M, Bertl A et al: TPK1, a Ca(2+)-regulated Arabidopsis vacuole two-pore K(+) channel is activated by 14-3-3 proteins. Plant J 2007, 52(3):449-459.