Die Rolle von Lipid-Nanodomänen für pflanzliche Signaltransduktionsprozesse
Die Rolle von Lipid-Nanodomänen für pflanzliche Signaltransduktionsprozesse
Lipid-Nanodomänen in der Plasmamembran (v.a. im tierischen System auch als „lipid rafts“ bezeichnet), sind kleine Membranbereiche, die durch eine spezielle Lipid- und Proteinzusammensetzung gekennzeichnet sind. In tierischen Zellen wurden solche Membrandomänen bereits als Plattformen charakterisiert, die an verschiedensten Signalweiterleitungsprozessen beteiligt sind. In den vergangen Jahren mehren sich Hinweise darauf, dass derartige Membrandomänen auch in pflanzlichen Zellen eine Rolle bei der Erzeugung und Weiterleitung von Signalen spielen könnten.
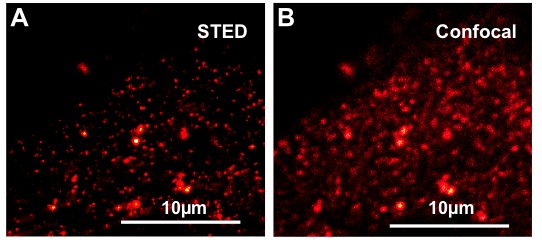
Wir konnten bereits zeigen, dass pflanzliche Membrandomänen als Plattformen für bestimmte Signalproteine während der durch das Phytohormon Abscisinsäure (ABA) vermittelten Antwort auf Trockenstreß dienen. In Mesophyllzellen von Arabidopsis thaliana sind alle ABA-Signalkomponenten, die zur Regulation membrangebundener Prozesse führen, zumindest zeitweise mit speziellen Domänen in der Plasmamembran assoziiert, die mithilfe von Markerproteinen wie z.B. Remorinen visualisiert werden können (s. Abbildung). Unter dem Einfluß von ABA interagiert der Anionenkanal SLAH3 mit der ihn phosphorylierenden Kinase CPK21 in solchen Membrandomänen und wird hierdurch aktiviert. In Abwesenheit des Phytohormons ABA blockiert die zentrale Protein Phosphatase ABI1 die Bildung des funktionellen Proteinkomplexes SLAH3/CPK21 und verhindert somit die Aktivierung des Anionenkanals.
Auch das NADPH/respiratory burst Oxidase Protein D (AtrbohD) wurde bereits als potentiell mit Nanodomänen der Plasmamembran assoziiert beschrieben. Durch NADPH-Oxidasen werden reaktive Sauerstoffspezies (ROS) generiert, die unter anderem während der pflanzlichen Antwort auf Pathogenbefall als second messenger dienen. In Arabidopsis Schließzellen sind ROS bzw. die zugrundeliegenden NADPH-Oxidasen auch an der Weiterleitung des ABA-Signals beteiligt. Wir untersuchen die Rolle der u.a. auch im Mesophyll lokalisierten AtrbohD für die dort stattfindenden Signaltransduktionsprozesse und wollen verstehen, welche funktionelle Relevanz die Assoziation dieses Proteins mit distinkten Domänen der Plasmamembran hat.
Derzeit finden verschiedene Methoden bei uns Anwendung, mit Hilfe derer wir die Rolle von pflanzlichen Membrandomänen untersuchen:
- Molekularbiologie: Klonierung, Expressionsanalysen (real-time qPCR)
- Biochemie: Isolierung von Membranfraktionen, Detektion/Identifikation der Proteine
- Proteomics: Untersuchung der Proteinzusammensetzung über massenspektrometrische Methoden. Enge Zusammenarbeit mit Y. Reinders (Universität Regensburg) und W.X. Schulze (Universität Hohenheim)
- Mikroskopische Visualisierung von Membrandomänen, darin enthaltenen Proteinen und Untersuchung der Proteindynamik: Konfokale Mikroskopie, Protein-Interaktionsstudien (FRET, BIFC), Fluorescence Lifetime Imaging Microscopy (FLIM, FRET-FLIM), Stimulated Emission Depletion (STED) Mikroskopie, Total Internal Reflection Fluorescence (TIRF) Mikroskopie. Enge Zusammenarbeit mit G.S. Harms (Wilkes University, Wilkes-Barre, USA)