Forschungsverbünde
SFB 1583: DECIDE (DECisions in Infectious DisEases)
Infektionskrankheiten sind weltweit eine der Hauptursachen für Leiden, Morbidität und Mortalität. Insbesondere die weltweite Zunahme multiresistenter Erreger und das konstante Auftreten neuer humanpathogener Keime stellen die moderne Medizin vor immense Herausforderungen.
Ausschließlich erregergeleitete Therapien führen zwar häufig zu einer erfolgreichen Behandlung des Patienten. Antibiotische, antimykotische oder antivirale Medikamente verursachen jedoch auch die Entstehung resistenter Keime. Zudem bleibt bei den derzeitigen therapeutischen Ansätzen die Immunreaktion des Wirts, die häufig zum tödlichen Ausgang vieler Infektionskrankheiten beiträgt, unberücksichtigt. Die Bekämpfung des Erregers allein hat daher oftmals keine ausreichende therapeutische Wirkung.
Ein Umdenken bei den therapeutischen Optionen ist daher notwendig. Es werden dringend Behandlungsstrategien benötigt, die sich auf die Optimierung der Wirtsreaktion konzentrieren, anstatt den Erreger selbst zu eliminieren. Insbesondere die Prozesse, die eine zunächst harmlose Infektion in eine schwere oder chronische Krankheit umwandeln, könnten für künftige therapeutische Maßnahmen genutzt werden, sind bisher aber wenig erforscht.
Ziel des Sonderforschungsbereichs DECIDE (DECisions in Infectious DisEases) ist es, molekulare Mechanismen im Wirt zu identifizieren, die den Verlauf von Infektionskrankheiten steuern. Insbesondere werden drei Schlüsselentscheidungen untersucht, die das klinische Ergebnis und die Schwere der Infektionen bestimmen:
(1) Eindämmung versus aktive Infektion nach dem ersten Kontakt
(2) aktive/akute versus persistierende/chronische Infektion
(3) lokalisierte Infektion versus systemischer Ausbreitung
Die langjährige Erfahrung der DECIDE-Forscher mit einem Repertoire an Krankheitserregern ermöglicht es ihnen, die Wechselwirkungen zwischen Mikroben, Barrieren (Geweben) und dem Immunsystem des Wirts sowie der Mikrobiota in einem einzigartigen mehrschichtigen Systemansatz zu untersuchen. Auf diese Weise wollen wir übergreifende gemeinsame und erregerspezifische molekulare Entscheidungspunkte in Infektionsprozessen identifizieren, die als Grundlage für neue Präventions- und Behandlungsansätze für Infektionskrankheiten dienen können.
Inno4Vac - innovations to accelerate vaccine development and manufacture
Inno4Vac ist ein neues interdisziplinäres Projekt, das von der Innovative Medicines Initiative 2 (IMI2) finanziert wird und darauf abzielt, Innovationen im Gesundheitswesen zu fördern, indem wissenschaftliche und technologische Erfolge aus dem akademischen und biotechnologischen Sektor in die Industrie eingebracht werden. Es wird von der European Vaccine Initiative (Deutschland) koordiniert, wobei die wissenschaftliche Koordination von der Sclavo Vaccines Association (Italien) übernommen wird. An dem Projekt sind 41 Partner aus 11 verschiedenen europäischen Ländern beteiligt, darunter 37 akademische Einrichtungen und KMU sowie GSK, Sanofi Pasteur, CureVac und Takeda als Industriepartner.
Im Rahmen dieser Inno4Vac-Initiative zielt der Lehrstuhl für Mikrobiologie auf die Entwicklung komplexer Infektionsmodelle der urovaginalen Schleimhaut ab, die in Bezug auf Struktur und Physiologie sowie zellautonome Immunreaktion dem nativen menschlichen Gewebe nahe kommen. Diese Modelle werden verwendet, um die Möglichkeit der Nutzung von Immunzellen der angeborenen und adaptiven Immunität zu untersuchen. Unser Schwerpunkt liegt auf Neisseria gonorrhoeae, um Infektionsmodelle zu etablieren. Diese Gewebemodelle werden für die Prüfung und Validierung von Impfstrategien verwendet.
GRK 2581: Metabolismus, Topologie und Kompartimentierung membrannaher Lipid- und Signalkomponenten in der Infektion
Ein gezielter Eingriff in den Umsatz von Sphingolipiden hat sich als eine erfolgreiche Strategie im Verlauf von Entzündungsprozessen erwiesen. Die Möglichkeit dies auch gegen Infektionskrankheiten auf der Ebene von Stoffwechsel und Immunkontrolle zu nutzen, erfordert jedoch weitere Untersuchungen. Daher beabsichtigt das GRK 2581 Zielstrukturen für neue Anti-Infektiva zu identifizieren und zu validieren sowie immuntherapeutische Strategien gegen Infektionskrankheiten durch Modulation des Sphingolipdstoffwechsels zu entwickeln.
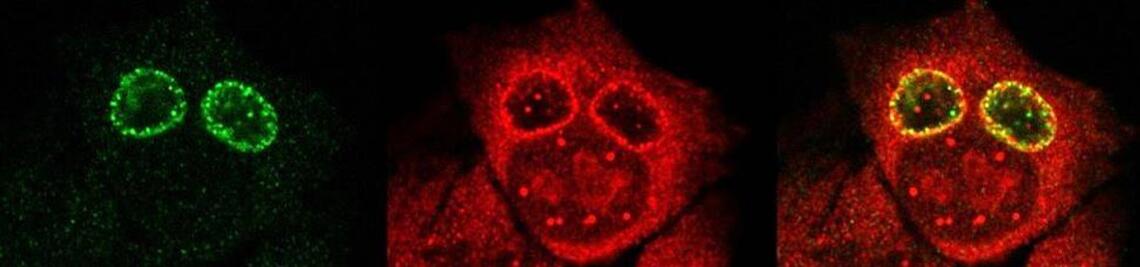
GRK 2243: Ubiquitylierung verstehen: Von molekularen Mechanismen zu Krankheiten
Das wissenschaftliche Ziel des Graduiertenkollegs GRK 2243 ist die Aufklärung biochemischer und pathogener Mechanismen, die mit dem Ubiquitinsystem in Zusammenhang stehenden Krankheiten zu Grunde liegen. Das Forschungsprogramm wird ein vertieftes mechanistisches Verständnis von krankheitsrelevanten Enzymen des Ubiquitinsystems hervorbringen, das die nachfolgende molekulare und zelluläre Analyse der pathogenen Folgen ihrer Fehlfunktion leiten wird. Das langfristige Ziel des Graduiertenkollegs ist die Identifizierung neuer Strategien zur Behandlung Ubiquitin-bedingter Erkrankungen.