Intrazellulärer Staphylococcus aureus und Wechselwirkungen mit dem Wirt oder Wirtszellen
Staphylococcus aureus verursacht eine Vielzahl von Krankheiten, deren Ausprägungen von Hautabszessen bis hin zu Endokarditis und Sepsis reichen. Das Erscheinen von Methicillin-resistenten S. aureus (MRSA) erschwert die Behandlung Infizierter mit den klassischen, verfügbaren Antibiotika. Zudem zeigen (unter anderem unsere) Forschungsergebnisse, dass die Bakterien auch innerhalb von Zellen des Menschen überleben können, beispielsweise in phagozytischen Immunzellen (Macrophagen und Neutrophile), aber auch von normalen Körperzellen wie etwa Zellen der Schleimhäute (Epithelzellen) oder des Gefäßsystems (Endothelzellen). Durch die Neutralisierung der antibakteriellen Eigenschaften dieser Zellen kann S. aureus im Wirt überleben. Innerhalb von Wirtszellen ist der Erreger dadurch sogar von Attacken des Immunsystems geschützt.
Zytotoxische S. aureus-Stämme entkommen nach der Phagozytose durch Zellen des Wirts häufig aus den entstehenden endozytischen Vesikeln. Danach vermehren sich die Bakterien im Zytoplasma, was in der Folge zum Tod der Wirtszellen führt, die dadurch die Bakterien wieder freisetzen. Welche bakteriellen Effektoren und Wirtsfaktoren an diesem komplexen Zusammenspiel beteiligt sind, ist noch weitgehend unbekannt.
Meine Forschungsgruppe verwendet gentechnisch veränderte Wirtszellen, die sogenannte Reportermoleküle produzieren. Diese sind meist fluoreszent und lassen sich so im Mikroskop gut verfolgen, um die Dynamik der Wirtszellinfektion durch S. aureus zu analysieren. Darüber hinaus setzen wir bakterielle Transposon-Mutanten in Verbindung mit neuartigen Sequenzierungs-Techniken ein, um bakterielle Virulenzfaktoren zu identifizieren, die für die Etablierung der Infektion in den jeweiligen Infektionsnischen des Erregers erforderlich sind.
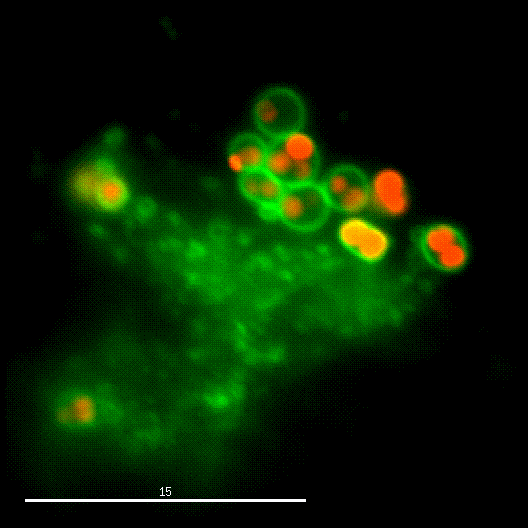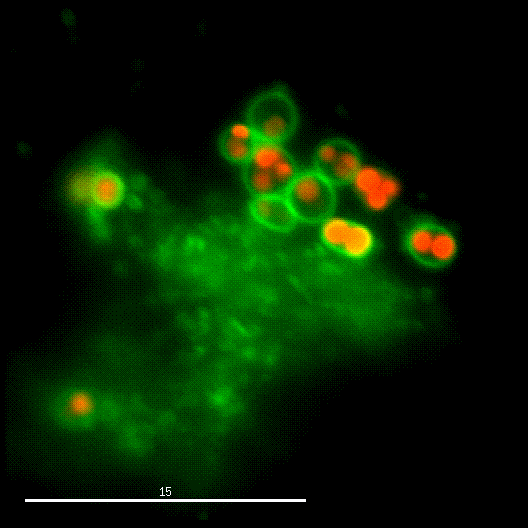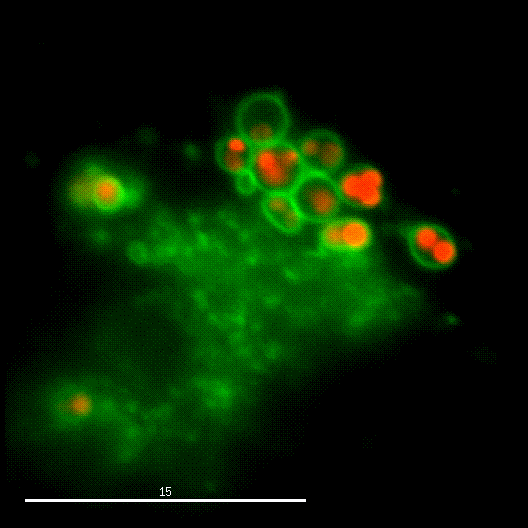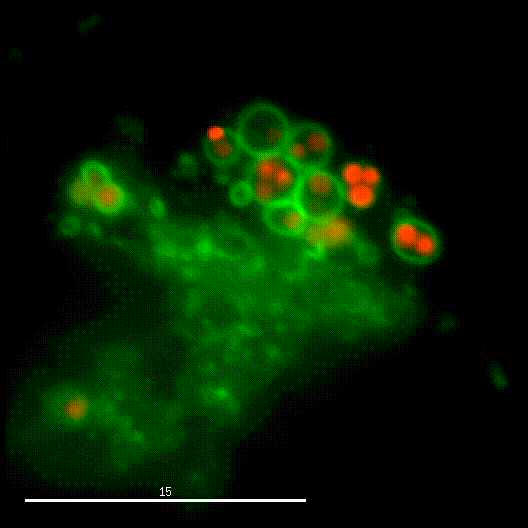
Ein Forschungsschwerpunkt der Gruppe ist die Interaktion von S. aureus mit Sphingolipiden auf der Wirtszelloberfläche, die daraus resultierende bakterielle Aufnahme und das intrazelluläre "Schicksal" der Bakterien. S. aureus produziert eine Vielzahl von plasmamembranaktiven Toxinen sowie eine bakterielle Sphingomyelinase und verschiedene andere Virulenzfaktoren, die zelluläre Membranen an der Wirtszelloberfläche oder in Endosomen modulieren oder permeabilisieren. Die Arbeitsgruppe untersucht dabei die Veränderung der bakteriellen Virulenz bei Veränderungen des Sphingolipidgehalts von Wirtsmembranen und umgekehrt.
Zusammen mit Prof. Dr. Christian Stigloher (Imaging Core Facility) wollen wir S. aureus-Infektionen auf Wirtsmembranen und deren Abhängigkeiten von Sphingolipiden auf der Ebene von Organismen verstehen, wofür Prof. Stigloher den genetisch vertretbaren Modellorganismus C. elegans als Infektionsmodell für S. aureus etabliert hat.
Durch die Zusammenarbeit mit der Abteilung Organische Chemie von Prof. Dr. Jürgen Seibel und der Abteilung Bioimaging von Prof. Dr. Markus Sauer, beide Mitglieder des RTG2581-Konsortiums, können wir nun modifizierte oder funktionalisierte Sphingolipide nutzen, um S. aureus-infizierte Zellen und die jeweiligen Wirtsmembranen mit Expansionsmikroskopie (ExM) bei hoher räumlicher Auflösung mit Standard-Konfokalmikroskopiegeräten sichtbar zu machen (siehe auch unten).
Ein weiterer Forschungsschwerpunkt des Labors ist die Ausbreitung des Erregers im Wirt. Gemeinsam mit Prof. Dr. Eva Media am HZI Braunschweig untersuchen wir sogenannte molekulare Entscheidungspunkte, die der systemischen Ausbreitung von Staphylococcus aureus durch den infizierten Wirtsorganismus zugrunde liegen. Unsere Untersuchungen basieren auf der Beobachtung, dass S. aureus in der Lage ist, sich über die Blutbahn des Wirts von einem anfänglichen lokalen Infektionsherd auf andere Organe auszubreiten. So kann der Erreger "metastatierende" oder chronische Infektionen verursachen. Aus der Blutbahn gelangt S. aureus zunächst in die Leber, wo gewebespezifische Makrophagen, sogenannte Kupffer-Zellen, die Bakterien aus dem Kreislauf filtern.
Gelingt es aber den Blut-Phagozyten oder den Kupffer-Zellen der Leber nicht, den Erreger vollständig zu eliminieren, so können sich die Bakterien auf sekundäre Organe wie Nieren und Knochen ausbreiten. Dort dämmen in der Regel bestimmte Zellen des Wirtsimmunsystems die Bakterien durch Abszessbildung ein. Jedoch kommt es auch hier vereinzelt dazu, dass die Bakterien aus den Abszessen entweichen und was zu einem Wiederauftreten der Infektion führen kann.
Hier wollen wir kritische Wirtsfaktoren identifizieren, die sogenannten molekularen Decision Points (Entscheidungsfaktoren), die die Fähigkeit der Phagozyten steuern, S. aureus aus der Blutbahn zu entfernen. In unserem Projekt C04 im Sonderforschungsbereich DECIDE haben wir die idealen Forschungsbedingungen, um diesen wichtigen Bereich der S. aureus-Infektionsbiologie zu untersuchen.
Auswahl der bereits publizierten Forschungsergebnisse
Ein Staphylococcus aureus Transkriptionsregulator vom LysR-Typ ist entscheidend für die bakterieller Besiedlung sekundärer Gewebe während der metastatischen Infektion über die Blutbahn
Zusammen mit Prof. Eva Medina (Helmholtz-Institut für Infektionsforschung, Braunschweig) haben wir kürzlich einen Transkriptionsregulator vom LysR-Typ in S. aureus identifiziert (LTTR), der für die Etablierung von Staphylokokkeninfektionen speziell in Nieren oder Knochen des Wirts erforderlich ist, aber für Leberinfektionen entbehrlich war. Zur Identifizierung verwendeten wir eine Screening-Prozedur, bei der eine Mischung von Tausenden von Transposon-Mutanten zur Infektion verwendet wurden. Mittels Sequenzierung aller Transposon-Insertionsstellen (TnSeq), wurde festgestellt, dass Mutanten in dem entsprechenden LTTR-Gen in dem primären Infektionsort, der Leber, noch vorhanden waren, aber in den sekundär besiedelten Nieren stark abgereichert waren.
Um das Regulon des Transkriptionsfaktors zu entschlüsseln, induzierten wir dessen Produktion und bestimmten das sogenannte Transkriptom mittels RNA-seq. Durch Fluoreszenzreporter konnten wir weiterhin Bedingungen finden, bei denen der Transkriptionsfaktor aktiviert wurde (z.B., Abwesenheit von Glukose, Vorhandensein von Kupferionen). Unsere Ergebnisse deuten somit auf die metabolische Anpassung des Erregers an unterschiedliche Infektionsnischen im Wirt hin. Durch die Analyse von essentiellen Genen und dem Transkriptomen von S. aureus können wir also etwas über die spezifischen Bedingungen im Wirt erfahren, die das Pathogen dort erfährt.
Lit. :
- Groma M, Horst SA, Das S, Huettel B, Klepsch M, Rudel T, Medina E, Fraunholz M (2020) Identification of a Novel LysR-Type Transcriptional Regulator in Staphylococcus aureus That Is Crucial for Secondary Tissue Colonization during Metastatic Bloodstream Infection. mBio 11(4):e01646-20
Der Transkriptionsregulator Rsp aus Staphylococcus aureus ist entscheidend für die Zytotoxizität des Bakteriums und natürliche Mutationen in seinem Gen bewirken einen Wechsel von akuten zu persistenten Infektionen
Eine ähnliche TnSeq-Strategie wurde von uns bereits bei der Analyse von Lungeninfektionen durch S. aureus angewandt. Dabei kristallisierte sich der Transkriptionsfaktor Rsp als notwendig heraus. S. aureus rsp-Mutanten wiesen eine reduzierte Zytotoxizität und waren bei Lungeninfektionen weniger virulent. Bei der Identifizierung des Rsp-Regulons wurde u.a. die lange, nicht-kodierende RNA SSR42 (lncRNA) als Ziel von Rsp identifiziert. Sowohl rsp als auch SSR42 Mutanten verloren größtenteils ihre hämolytischen und zytotoxischen Eigenschaften. Interessanterweise entstehen rsp-Mutanten von S. aureus auch auf natürlichem Weg. So fanden unsere Kooperationspartner aus Oxford, dass S. aureus während der Kolonisierung des Menschen (meist im vorderen Nasenbereich) Mutationen im rsp-Locus erwerben kann, die den S. aureus-Pathotyp beeinflussen. Die Funktion der Rsp -regulierten lncRNA SSR42 bleibt aber noch rätselhaft.
Lit.:
- Das S, Lindemann C, Young BC, Muller J, Österreich B, Ternette N, Winkler AC, Paprotka K, Reinhardt R, Förstner KU, Allen E, Flaxman A, Yamaguchi Y, Rollier CS, van Diemen P, Blättner S, Remmele CW, Selle M, Dittrich M, Mueller T, Vogel J, Ohlsen K, Crook DW, Massey R, Wilson DJ, Rudel R, Wyllie DH, Fraunholz MJ (2016) Natural mutations in a Staphylococcus aureus virulence regulator attenuate cytotoxicity but permit bacteremia and abscess formation. PNAS 113:E3101-10
- Horn J, Klepsch M, Manger M, Wolz C, Rudel T, Fraunholz M (2018) Long Noncoding RNA SSR42 Controls Staphylococcus aureus Alpha-Toxin Transcription in Response to Environmental Stimuli. Journal of Bacteriology 200(22)
Phenol-lösliche Moduline und eine nicht-ribosomale Peptidsynthase von Staphylococcus aureus sind in Epithelzellen am phagosomalen Ausbruch des Erregers beteiligt
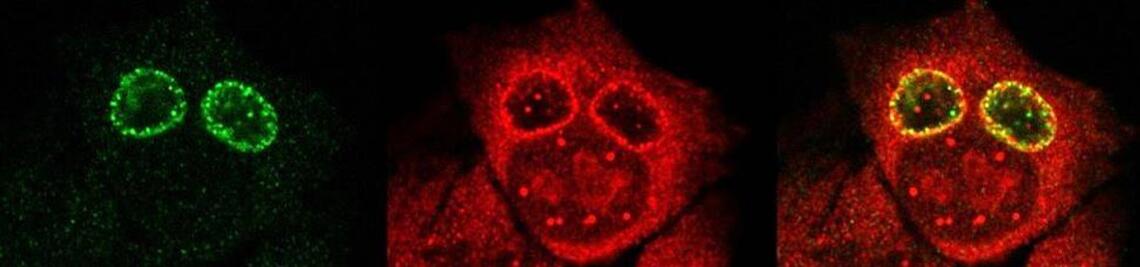
Der phagosomale Ausbruch führt dazu, dass S. aureus nach der Internalisierung durch, zum Beispiel, Epithelzellen in das Cytoplasma der Wirtszellen gelangt, wo sich der Erreger vermehren kann.
Zur Identifizierung von bakteriellen Faktoren, die für diesen Ausbruch erforderlich sind, entwickelten wir ein fluoreszentes Ausbruch-Reporter Molekül, welches wir in den Wirtszellen produzieren. Die so veränderten Zellen zeigen uns im Mikroskop an, ob die Bakterien im Zytoplasma vorliegen. Durch die Infektion dieser Reporterzellen mit verschiedensten Bakterienmutanten identifizierten wir bakterielle Kandidatengene, deren Mutation zum Verlust der Ausbruchsfähigkeit von S. aureus führten. Eine nicht-ribosomale Peptidsynthase (NRPS) von S. aureus waren dabei erforderlich. Bakterielle Mutanten in den NRPS-Genen waren sowohl in vitro als auch in vivo deutlich in ihrer Virulenz abgeschwächt. Wie jedoch die NRPS den phagosomalen Ausbruch von S. aureus beeinflusst ist noch ungeklärt.
Bereits früher, identifizierte meine Gruppe die sogenannten Phenol-löslichen Moduline (PSM) als Ausbruchsfaktoren. Diese sind kurze Proteinketten mit amphiphilen Charakter. Dabei sind in klinischen Stämmen die Gruppe der PSMα wichtig, während die Induktion anderer PSMs in Laborstämmen zum Ausbruch aus dem Phagosom führt. Dies bleibt weiter ein Fokus der Arbeitsgruppe.
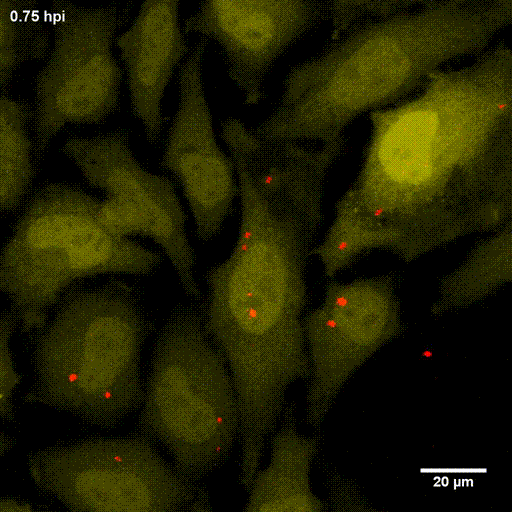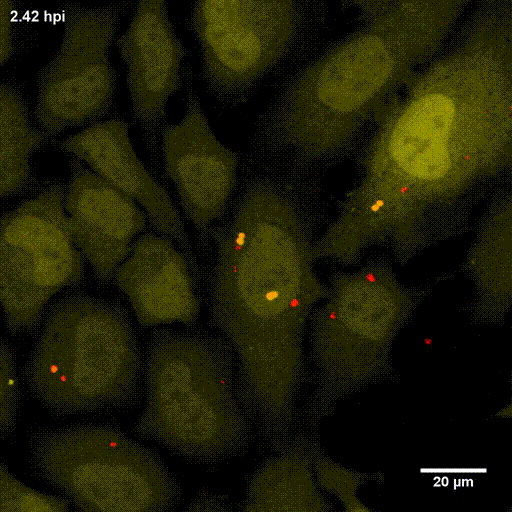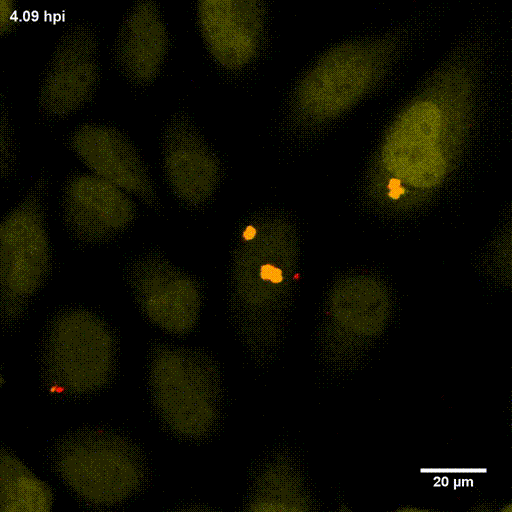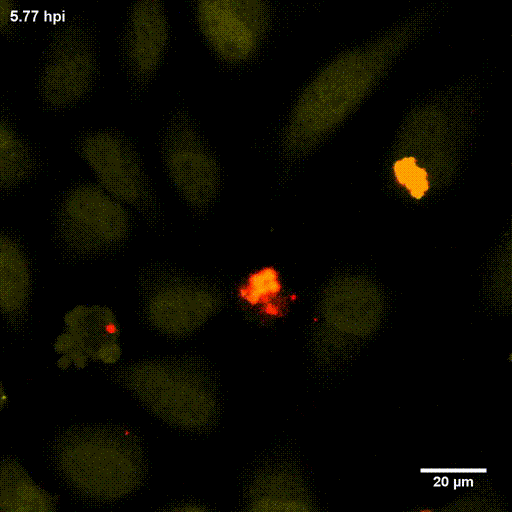
Lit.:
- Blättner S, Das S, Paprotka K, Eilers U, Krischke M, Kretschmer D, Remmele CW, Dittrich M, Müller T, Schuelein-Voelk C, Hertlein T, Mueller MJ, Huettel B, Reinhardt R, Ohlsen K, Rudel T, Fraunholz MJ (2016) Staphylococcus aureus Exploits a Non-ribosomal Cyclic Dipeptide to Modulate Survival within Epithelial Cells and Phagocytes. PLoS Pathogens 12:e1005857
- Grosz, M., Kolter, J., Paprotka, K., Winkler, A.C., Schafer, D., Chatterjee, S.S., Geiger, T., Wolz, C., Ohlsen, K., Otto, M., Rudel, T., Sinha, B. and Fraunholz, M. (2014). Cytoplasmic replication of Staphylococcus aureus upon phagosomal escape triggered by phenol-soluble modulin alpha. Cell Microbiol 16, 451-465.
Intrazelluläre Staphylococcus aureus verursachen Wirtszelltod über die Veränderung des Kalziumspiegels und die bakterielle Cysteinprotease Staphopain A
Einmal im Wirtscytoplasma angekommen, kann sich S. aureus vermehren (YouTube-Video von Dr. Kathrin Stelzner https://www.youtube.com/watch?v=OqCVZ_S10rw) und kurz darauf sterben infizierte Wirtszellen ab. Bei einer Staphylokokkeninfektion werden dabei auch die Konzentrationen des Kalziums innerhalb menschlicher Zellen verändert.
Zusammen mit der Gruppe von Thomas Rudel konnten wir weiterhin zeigen, dass für den Tod der Wirtszellen die bakterielle Cysteinprotease Staphopain A (ScpA) im Zytoplasma benötigt wird. Die Angriffspunkte im Wirtszytoplasma sind jedoch noch unbekannt.
Lit..:
- Stelzner K, Winkler AC, Liang C, Boyny A, Ade CP, Dandekar T, Fraunholz MJ, Rudel T (2020) Intracellular Staphylococcus aureus Perturbs the Host Cell Ca2+ Homeostasis To Promote Cell Death. mBio 11(6):e02250-20
- Stelzner K, Boyny A, Hertlein T, Sroka A, Moldovan A, Paprotka K, Kessie D, Mehling H, Potempa J, Ohlsen K, Fraunholz MJ, Rudel T (2021) Intracellular Staphylococcus aureus employs the cysteine protease staphopain A to induce host cell death in epithelial cells. PLoS Pathogens 17(9):e1009874.
Staphylococcus aureus-α-Toxin führt zur Aktivierung von Sphingomyelinase-abhängigen Membranreparaturmechanismen an der Plasmamembran der Wirtszelle
S. aureus besitzt verschiedene porenbildenden Toxine. α-Toxin, kann dabei einen Kalziumeinstrom in das Zytoplasma der Wirtzellen. Permeabilisierte Wirtszellmembranen werden durch einen Mechanismus repariert, der die Endozytose geschädigter Membranen sowie die Rekrutierung von Membranreparaturenzymen umfasst. Zu letzteren zählt etwa die saure Sphingomyelinase (ASM). ASM ist in der Regel in den Lysosomen lokalisiert. Periphere Lysosomen werden zur Reparatur der Zellmembran an die Oberfläche der Wirtszellen rekrutiert. Dies wurde bereits bei vielen porenbildenden Toxinen gezeigt und dtellt somit einen konservierten Reparaturmechanismus dar. Unsere Ergebnisse deuten daraufhin, dass Membranverletzungen durch α-Toxin mit eben diesem Mechanismus reparierte werden. Wir untersuchen daher derzeit den Beitrag der Sphingolipide zur zellulären Mikrobiologie von S. aureus im Rahmen von GRK2581 SPHINGOINF.
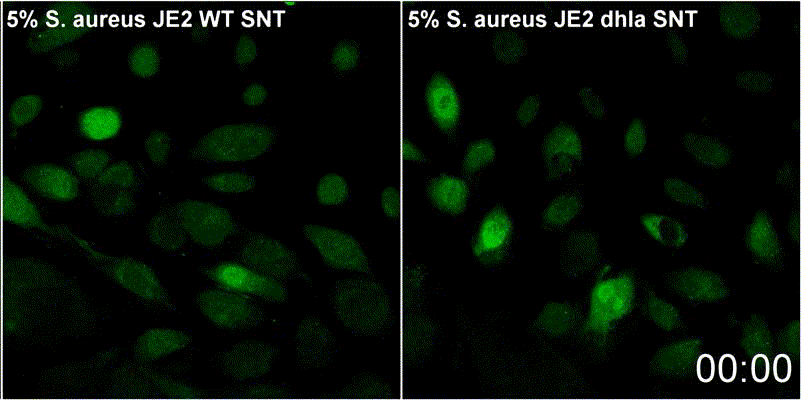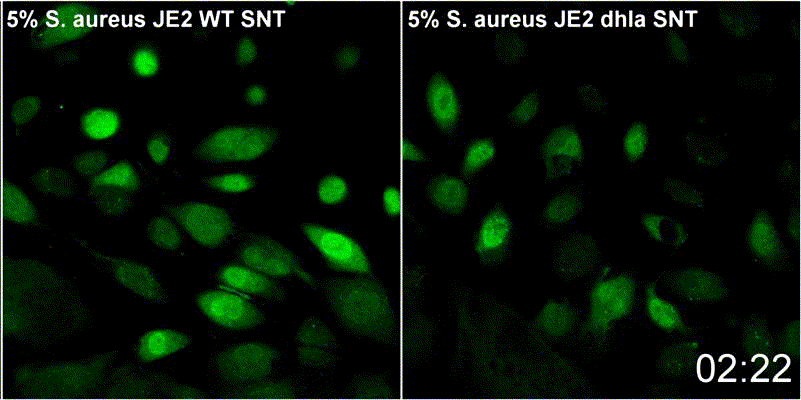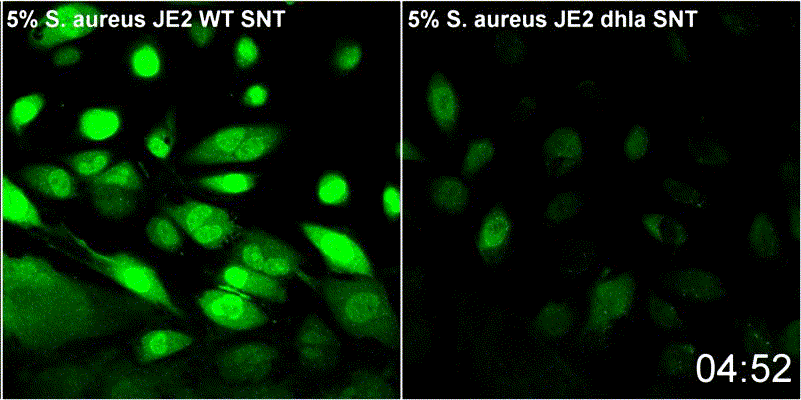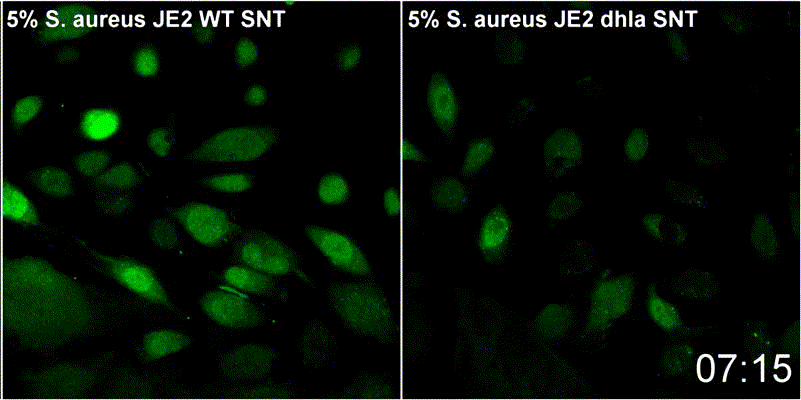
Lit.:
- Krones D, Rühling M, Becker KA, Kunz TC, Sehl C, Paprotka K, Gulbins E, Fraunholz M (2021) Staphylococcus aureus α-Toxin Induces Acid Sphingomyelinase Release From a Human Endothelial Cell Line. Frontiers in Microbiology 12:694489
Expansionsmikroskopie von Staphylococcus aureus erfordert einen spezifischen Protease-Cocktail
Da viele unserer Forschungsfragen Fluoreszenzmikroskopie erfordern, haben wir untersucht, ob die so genannte Expansionsmikroskopie (ExM) auf S. aureus oder S. aureus-infizierte Zellen anwendbar ist. Die ExM umgeht die Auflösungsbeschränkung klassischer Mikroskopietechniken, indem sie die an eine Gelmatrix fixierte Probe anschwellen lässt – eben: expandiert. Dabei muss auch die rigide Staphylokokken-Zellwand aufgebrochen werden. Dies wurde durch die Anwendung spezifischer Proteasen möglich. Nun können wir die Wirts-Pathogen-Interaktionen mit mindestens vierfach höherer Auflösung darstellen als es die herkömmliche konfokale Fluoreszenzmikroskopie erlaubt.
Lit.:
- Kunz TC, Rühling M, Moldovan A, Paprotka K, Kozjak-Pavlovic V, Rudel T, Fraunholz M (2021) The Expandables: Cracking the Staphylococcal Cell Wall for Expansion Microscopy. Frontiers in Cellular and Infection Microbiology 11:644750
Assoziationen
Wir sind mit dem DFG-Schwerpunktprogramm SPP2225 EXIT assoziiert, einem Forschungskonsortium, das "Exit-Strategien" von intrazellulären Pathogenen untersucht. SPP2225 erforscht dabei konvergent evolvierte Wege von bakteriellen, parasitischen und pilzlichen Krankheitserregern aus menschlichen Zellen oder Geweben auszubrechen.
Verfügbarkeit von Materialien
Unser Ausbruchsreporter YFP-CWT (https://www.addgene.org/176689/) sowie die in S. aureus brillant fluoreszierenden Proteine Cerulean (cyanfarben) (https://www.addgene.org/24756/) und das orangerote mRFPmars (https://www.addgene.org/26252/) gibt es derzeit bei AddGene.