Fanconi Anämie
Fanconi-Anämie (FA) ist eine seltene genetische Erkrankung, die mit Ausnahme von FANCB und FANCR einer autosomal rezessiven Vererbung folgt. Derzeit sind Mutationen in 22 FA Genen bekannt, wobei die meisten Patienten Mutationen in FANCA, FANCC und FANCG aufweisen. Ein Funktionsverlust in einem der FA-Gene führt zu einer erhöhten genetischen Instabilität, die sich in allen Zellen, insbesondere nach Gabe von DNA-Doppelstrang-quervernetzenden Substanzen, wie Mitomycin C oder Diepoxybutan, nachweisen lässt.
Mit einer geschätzten Häufigkeit von weniger als 1 in 130,000 Geburten (Rosenberg et al., AJMG, 2011) gehört FA zu den seltenen genetischen Erkrankungen. Die Patienten entwickeln meist ein fortschreitendes Knochenmarksversagen bzw. AML, MDS oder ALL. Für die Behandlung und Betreuung von FA-Patienten ist eine sichere Diagnose essenziell, um geeignete Protokolle zu verwenden und die entsprechenden Vorsorgemaßnahmen zu ergreifen. Insbesondere bifunktionelle, DNA-vernetzende Substanzen, wie Cisplatin oder Mitomycin C, sind bei allen therapeutischen Maßnahmen zu vermeiden. Auch mögliche andere Gefahren, z.B. durch ionisierende Strahlung, sind im Einzelfall abzuwägen.
Die funktionelle Diagnostik hat auch im „NGS-Zeitalter“ eine Schlüsselrolle als schnelles, kostengünstiges Screening-Verfahren, das ohne Kenntnis der betroffenen FA-Gene durchgeführt werden kann. Dies ist insbesondere hervorzuheben, nachdem ca. 80% der Patienten mit Knochenmarksversagen keine Störungen im FA/BRCA Pathway aufweisen (Oostra et al., Anemia, 2012). In diesen Fällen ist eine Mutationsanalyse in den 22 bekannten FA-Genen nicht zielführend bzw. ist bei Vorliegen einer heterozygoten Mutation schwierig zu interpretieren.
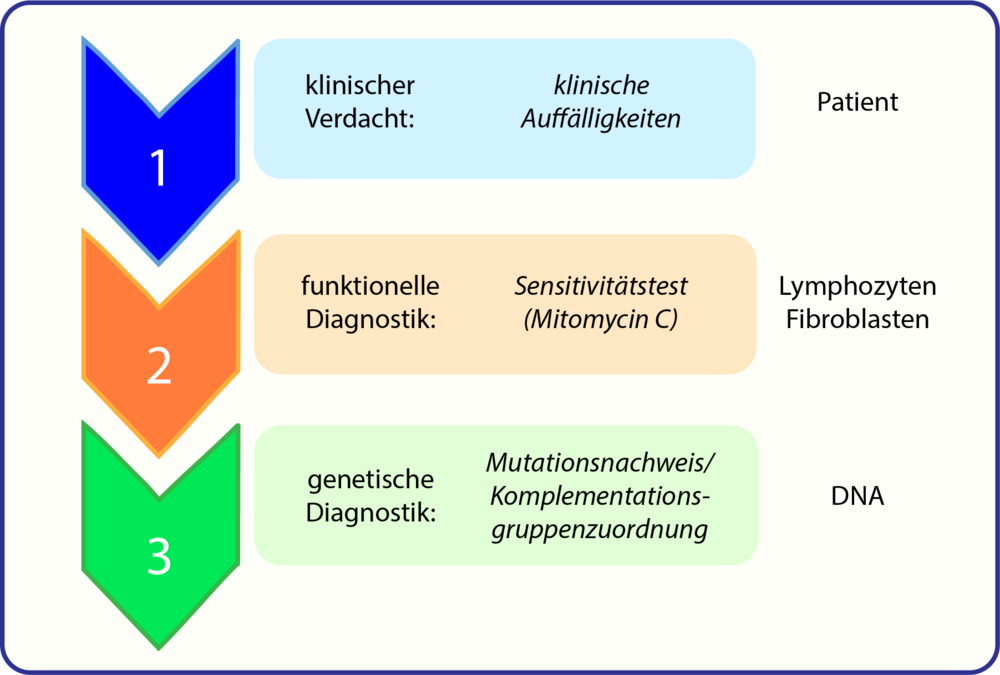
Unser bevorzugter Workflow ist wie folgt:
Klinische Auffälligkeiten:
- Meist entsteht der klinische Verdacht auf Fanconi-Anämie durch ein progressiv fortschreitendes Knochenmarksversagen im kindlichen Alter.
- Weiterhin liegen oftmals physische Auffälligkeiten vor, wobei diese einzeln oder in Kombination auftreten können:
• Pigmentierungsstörungen der Haut in Form von großen Café-au-lait Flecken (40%) und/oder einer • Hypopigmentierung
• Kongentiale Fehlbildungen (in ~35% of cases) des Skelets mit Daumen und/oder Radiusaplasie, Hüftdysplasie oder Syndaktylie und der inneren Organe
• Augenfehlbildungen wie Katarakte, Microphthalmie, Strabismus oder Astigmatism
• Microzephalie
• Reduziertes Geburtsgewicht
• Kleinwüchsigkeit
Anmerkung: Etwa 25% der FA-Patienten weisen keine kongenitalen Fehlbildungen auf.
- Mit zunehmenden Alter steigt das Risiko neben dem Knochenmarksversagen einen „hämotopoetischen Tumor“ zu entwickeln. Hierbei sind insbesondere zu nennen:
• Myelodysplastisches Syndrom (MDS).
• Akute myeloische Leukämie (AML)
• Akute lymphatische Leukämie (ALL)
• Aplastische Anämie (SAA)
- Ein frühes Auftreten von festen Tumoren im Mund- und Rachenbereich ist bei Patienten mit FA gehäuft zu finden. Auch ohne weitere Anzeichen ist daher bei einer Diagnose im Alter von 20-30 Jahren ein Ausschluss von FA zu empfehlen. Weiterhin wurden, wenngleich selten, das Auftreten von Cervixkarzinomen, Eierstockkrebs und Leberkarzinomen beschrieben.
Funktionelle Diagnostik
In der Diagnostik macht man sich die FA-charakteristische spontane und induzierbare genetische Instabilität zu nutze. Exponiert man Zellen von FA-Patienten mit DNA-quervernetzenden Substanzen, wie Mitomycin C, kommt es zu einer Vielzahl eine Vielzahl von DNA-Einzelstrang- bzw. DNA-Doppelstrangbrüchen, die in der Metaphase zu Tri- bzw. Quadriradialfiguren führen können.
Dieses zelluläre Merkmal, welches von Frau Prof. Dr. Schroeder erstmals 1964 beschrieben wurde, ist bis heute ein diagnostisches Merkmal für Fanconi Anämie. Allerdings hat diese Methode einige technische Limitationen, die sich mit einer neueren Methode umgehen lassen. Die klassische Chromosomenbruchanalyse ist abhängig von Zellen, die sich gerade in der Metaphase des Zellzykluses befinden. Doch gerade die Herstellung von Präparaten mit aussagekräftigen Metaphasen ist bei FA-Patienten oftmals eine Herausforderung:
• Die Patienten entwickeln mit fortschreitendem Lebensalter eine Anämie (Durchschnittsalter 7 Jahre), welche oftmals zum Verdacht Fanconi-Anämie führt.
• Die Lymphozyten von FA-Patienten zeigen allgemein eine verminderte Stimulierbarkeit, welche durch eine medikamentöse Vorbehandlung weiter vermindert werden kann.
• Zellen von FA Patienten arretieren nach MMC-Gabe in der G2-Phase des Zellzykluses.
Weitere Variablen entstehen durch die Wertung der Brüche/ Chromosomenaberrationen, der Qualität der Präparation und nicht zuletzt durch die Anzahl der analysierten Metaphasen.
Die von uns verwendete Diagnostik mittels Durchflusszytometrie basiert auf einer MMC-abhängigen Arretierung der Zellen in der G2-Phase des Zellzykluses, welche ein Maß für die chromosomale Schädigung ist. Mittels BrdU-Quenching werden die einzelnen Zellzyklen separat analysiert, um das Wachstumsverhalten zu berücksichtigen (Methodik siehe Springer Verlag, Lab Manual: Diagnostic Cytogenetic, Chapter 15 (1999) oder Karger, Monographs in Human Genetics Vol. 15, Fanconi Anemia (2007). Zur Evaluierung wurden Mitte der 90iger Jahre Patientenproben parallel von Frau Prof. Dr. Schroeder-Kurth (Heidelberg) mit der klassischen Chromensomenbruchanalyse und von Herrn Prof. Dr. Schindler (Würzburg) mittels Durchflusszytometrie untersucht. Beide Methoden kamen zum gleichen Ergebnis. Eine direkte Korrelation zwischen der Anzahl von DNA-Brüchen und der Stärke des Zellzyklus-Arrests in der G2-Phase wurde von Frau Dr. Sauer in ihrer Promotionsarbeit am Charité Berlin (2012) nachgewiesen.
Inzwischen ist der MMC-induzierte G2-Phase Arrest ein international akzeptiertes Charakteristikum für FA und wurde in einer Vielzahl von Publikationen als Marker verwendet (siehe beispielsweise Bridge et al. (2005) Nature Genetics, Kalb et al. (2007) American Journal of Human Genetics, Vaz et al. (2010) Nature Genetics, Schuster et al. (2012) Human Mutation, Bluteau et al. (2016) Journal of Clinincal Investigations).
Der Vorteil der Durchflusszytometrie ist, dass jede Messung auf tausenden von Einzelmesswerten basiert, die anschließend elektronisch ausgewertet werden. So können in der Analyse die stimulierten Zellen separat betrachtet werden, wodurch man sowohl Auskunft über den Zellzyklus als auch die Teilungsfähigkeit bekommt. Eine Abhängigkeit von der Metaphase liegt dabei nicht vor, weswegen auch Proben mit relativ wenigen Zellen zu einem sicheren Ergebnis führen. Ein Anteil von 20% an stimulierbaren Zellen ist für unsere Analyse bereits ausreichend.
Die von uns angewandte Methode wird sowohl durch das „Netzwerk über angeborene Störungen der Blutbildung“ der Universitäten Hannover, Freiburg, Münster, Berlin, Düsseldorf und der medizinische Universitätsklinik Ulm (http://www.bone-marrow-failure-syndromes.de/erkrankungen/arztinfo_fa.htm) als auch vom amerikanischen „Fanconi Anemia Research Fund“ (siehe, Fanconi Anemia: Guidelines for Diagnosis and Management (2014)) als diagnostische Methode anerkannt.
Die Gesellschaft für Pädiatrische Onkologie und Hämtologie (GPHO) genehmigte im Mai 2012 den Aufbau eines Fanconi-Anämie Registers mit Herrn Prof Dr. Kratz und Herrn Prof. Dr. Hanenberg in der Studienleitung. In diesem Studienregister ist das Fanconi-Labor in Würzburg unter Punkt 21 “Documentation of the diagnostic procedure” als Referenzlabor angegeben. Auch im Handbuch der Deutschen Fanconi-Anämie-Hilfe e.V. (2005) ist die Diagnostik mittels Durchflusszytometrie explizit erläutert (Kapitel 17, S.170/171).
Anforderung zur funktionellen FA-Diagnostik
Die funktionelle Diagnostik ist abhängig von proliferierenden Zellen, welche jedoch bei Patienten mit FA oftmals eingeschränkt ist. Daher bitten wir, dass Blutproben uns so früh wie möglich (innerhalb von 2 Tagen) erreichen.
Zur Durchführung der Diagnostik benötigen wir:
• Auftrag und Einverständniserklärung des Patienten
• Kostenstelle/ Überweisungsschein 6
• 10 ml Heparin-Blut
• klinische Information
Bei Vorliegen eines hämatopoetischen Mosaiks bzw. bei einigen seltenen FA-Subtypen (z.B. FANCD1 und FANCN) empfehlen wir die Analyse von Fibroblasten.
Molekulargenetische Diagnostik
Mutationen in 22 Genen sind bisher mit Fanconi-Anämie assoziiert (siehe Genliste), wobei die meisten Patienten den Komplementationensgruppen FA-A, -B, -C, -D1, -D2, -E, -F, -G, -I und -J zugeordnet werden können. Neben den Einzelgenanalysen bieten wir daher auch verschiede Panels an, welche sich in der Auswahl von FA-Genen an den kassentechnischen Vorgaben (25 kb) mit einer bestmöglichen Abdeckung orientieren. Bereits mit einer Analyse von sechs Genen (FANCA, FANCB, FANCC, FANCE, FANCF und FANCG) können wir nahezu 90% der FA-Patienten zuordnen.
Vor Beginn einer genetischen Analyse wäre jedoch eine funktionelle Absicherung der Diagnose anzuraten.
Liste aller bekannten FA-Gene
| Gen | Weitere Bezeichnungen | OMIM | Genlocus | Funktion im FA/BRCA-Signalweg | Ungefährer Anteil in FA [%]* |
| FANCA | 607139 | 16q24.3 | Kernkomplex | 65,1 | |
| FANCB | FAAP90; FAAP95 | 300515 | Xp22.2 | Kernkomplex | 1,8 |
| FANCC | 613899 | 9q22.3 | Kernkomplex | 10,1 | |
| FANCD1 | BRCA2 | 600185 | 13q12.3 | Homologe Rekombination | 2,4 |
| FANCD2 | 613984 | 3p25.3 | ID-Komplex | 2,6 | |
| FANCE | 613976 | 6p21.31 | Kernkomplex | 1,2 | |
| FANCF | 613897 | 11p14.3 | Kernkomplex | 1,5 | |
| FANCG | XRCC9 | 602956 | 9p13.3 | Kernkomplex | 9,7 |
| FANCI | KIAA1794 | 611360 | 15q26.1 | ID-Komplex | 1,4 |
| FANCJ | BRIP1; BACH1 | 605882 | 17q23.2 | 5'-3'-Helikase | 1,8 |
| FANCL | PHF9; FAAP43 | 608111 | 2p16.1 | Kernkomplex | 0,3 |
| FANCM | FAAP250 | 609644 | 14q21.3 | Kernkomplex | 0,1 |
| FANCN | PALB2 | 610355 | 16p12.2 | Homologe Rekombination | 0,6 |
| FANCO | RAD51C | 613390 | 17q22 | Homologe Rekombination | 0,1 |
| FANCP | SLX4; BTBD12 | 613951 | 16p13.3 | Lösen von Crosslinks | 0,5 |
| FANCQ | ERCC4; XPF | 615272 | 16p13.12 | Struktur-spezifische Endonuklease | 0,1 |
| FANCR | RAD51 | 617244 | 15q15.1 | Homologe Rekombination | 0,1 |
| FANCS | BRCA1 | 113705 | 17q21.31 | Homologe Rekombination | >0,1 |
| FANCT | UBE2T; HSPC150 | 616435 | 1q32.1 | E2-Ubiquitin-konjugierendes Enzym | 0,2 |
| FANCU | XRCC2 | 617247 | 7q36.1 | Homologe Rekombination | >0,1 |
| FANCV | REV7/MAD2L2 | 617243 | 1p36.22 | Transläsions-Synthese | >0,1 |
| FANCW | RFWD3 | 617784 | 16q22.3 | Homologe Rekombination | >0,1 |
* prozentualer Anteil berechnet nach den Einträgen in der IFAR Registry (Stand 01.2017)
Auftrag zur molekulargenetischen Diagnostik
Zur Durchführung der molekulargenetischen Diagnostik bitten wir Sie um:
• Auftrag und Einverständniserklärung des Patienten (Einzelgen-Analyse, NGS-Panel)
• Überweisungsschein 10
• 5-10 ml Heparin-Blut
• klinische Information bzw. vorhandene Befunde